题目内容
某元素的最高正价与其负价的绝对值之差为4,该元素的离子与跟其核外电子排布相
同的离子形成的化合物是( )
A K2S B MgO C MgS D NaF
A
解析试题分析:某元素的最高正价与其负价的绝对值之差为4,则该元素为S;其离子的核外电子排布是2、8、8,所以与跟其核外电子排布相同的离子是K+或Ca2+。根据题目提供的信息可知:它们形成的化合物的化学式为K2S。选项为A。
考点:考查元素的推断及化合物的化学式的确定的知识。

练习册系列答案
相关题目
在短周期元素中,A元素的最高正化合价和最低负化合价的绝对值之差为6,A元素与B元素可以形成化合物BA2,A的阴离子与B的阳离子具有相同的电子层结构,则该化合物是 ( )
| A.MgCl2 | B.CaCl2 | C.SiO2 | D.CS2 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法正确的是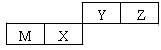
| A.原子半径Z > Y |
| B.X 的最简单气态氢化物的热稳定性比Z的小 |
| C.Y的最高价氧化物对应水化物的酸性比X 的弱 |
| D.M的最高价氧化物对应水化物不能与NaOH溶液反应 |
有4组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如表所示,则下列各项判断正确的是( )
| 第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 第四组 | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
B.第三组与第四组相比较,化合物的稳定顺序为:HBr<d
C.第三组物质溶于水后,溶液的酸性c最强
D.第四组物质中H2O的沸点最高,是因为H2O分子间存在氢键
下列判断正确的是
| A.根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
| C.晶体中一定存在化学键 |
| D.正四面体分子中键角只能是109°28′ |
对于元素周期表, 下列叙述中不正确的是( )
| A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 |
| C.在金属元素区域可以寻找制备新型农药材料的元素 |
| D.元素周期表是元素周期律的具体表现形式 |
已知X,Y声是元素周期表中前20号元素:|x-y|="3," X, Y能形成化合物M,下列说法正
确的是
| A.若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 |
| B.若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性 |
| C.若M属于共价化合物,则该分子中原子个数比可能为1:2 |
| D.若M属于离子化合物,则该化合物中只存在离子键 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,其最外层电子数之和等于24,由此可知说法错误的是( )
| W | X | |
| | Y | Z |
A.原子半径大小:W>X
B.元素最高正价:W>Z
C.简单阴离子的还原性:Y>Z
D.气态氢化物的稳定性:X>Y
下列关于物质结构、性质的说法正确的是
| A.因为酸性:HCl>H2CO3,所以非金属性:Cl>C |
| B.同一周期元素的原子,半径越小越容易失去电子 |
| C.K的原子半径比Na的原子半径大,K与水反应比Na与水反应更剧烈 |
| D.离子化合物中可能含有共价键,共价化合物中可能含有离子键 |