题目内容
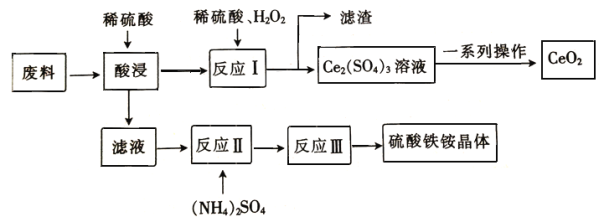
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如图。
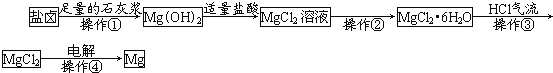
下列说法正确的是( )
A.操作①发生的反应为氧化还原反应
B.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
C.操作②是蒸发浓缩、冷却结晶
D.在整个制备过程中,发生复分解反应、氧化还原反应、分解反应、置换反应
【答案】C
【解析】
盐卤加入足量石灰浆沉淀镁离子生成氢氧化镁沉淀,过滤得到沉淀加入适量盐酸溶解得到氯化镁溶液,通过蒸发浓缩结晶得到氯化镁晶体,在氯化氢气流中失水得到固体氯化镁,电解熔融氯化镁得到金属镁。
A.盐卤和氢氧化钙发生复分解反应生成氢氧化镁,为复分解反应,不是氧化还原反应,故A错误;
B.操作①为过滤操作,滤操作中需要使用漏斗和烧杯、玻璃棒,故B错误;
C.操作②是MgCl2溶液得到MgCl2晶体,需要蒸发浓缩结晶,故C正确;
D.题中涉及反应有氢氧化钙与氯化镁的反应、氯化镁与盐酸的反应以及电解氯化镁,只发生复分解反应、氧化还原反应、分解反应,未发生置换反应,故D错误。
故选:C。

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目