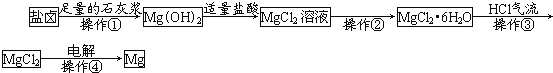题目内容
【题目】已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。请回答下列问题:
(1)NH3、H2O2分子中电负性最大的元素在周期表中的位置为___,第一电离能最大的元素为___。
(2)铬的原子序数为24,其基态电子排布式为___。
(3)1molN2H4分子中含有的σ键数目为___。
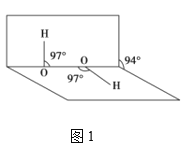
(4)H2O2分子结构如图1,其中心原子杂化轨道类型为___,估计它难溶于CS2,简要说明原因___。
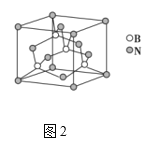
(5)氮化硼晶胞如图2所示,处于晶胞顶点上的原子的配位数为___,若立方氮化硼的密度为ρgcm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为___cm。
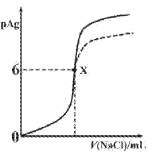
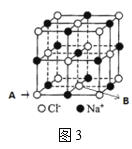
(6)如图3所示,若将A离子移到晶胞的体心,则B离子移到了___(填顶点,面心或棱心)。
【答案】第二周期ⅥA族 N 1s22s22p63s23p63d54s1 3.01×1024或5NA sp3 H2O2为极性分子,CS2为非极性溶剂,所以H2O2不能溶解在CS2中 4 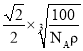 棱心
棱心
【解析】
(1)根据同一周期从左往右电负性增大,同一主族从上往下,电负性减小,故再H、N、O中电负性最大的元素是O,其在周期表中的位置为第二周期ⅥA族,第一电离能同一周期从左往右呈增大趋势,ⅡA与ⅢA、ⅤA与ⅥA反常现象,同一主族从上往下,第一电离能减小,最大的元素为N,故答案为:第二周期ⅥA族 N;
(2)铬的原子序数为24,其基态电子排布式为1s22s22p63s23p63d54s1或者[Ar] 3d54s1,故答案为:1s22s22p63s23p63d54s1或者[Ar] 3d54s1;
(3)根据N2H4的结构式![]() 可知,1molN2H4分子中含有的σ键数目为5mol或3.01×1024,故答案为:3.01×1024或5NA;
可知,1molN2H4分子中含有的σ键数目为5mol或3.01×1024,故答案为:3.01×1024或5NA;
(4)根据H2O2分子结构,可知每个氧原子周围均呈V型,故其中心原子O杂化轨道类型为sp3,溶解性可以用相似相溶原理,故H2O2分子难溶于CS2的原因可能是:H2O2是极性分子,而CS2是非极性分子,故答案为:sp3 H2O2为极性分子,CS2为非极性溶剂,所以H2O2不能溶解在CS2中;
(5)根据氮化硼晶胞结构可知,处于晶胞顶点上的原子的配位数即与氮原子最近且距离相等的硼原子,从图中可以知道为4,每个晶胞中含有的N原子数为![]() ,硼原子个数为4个,设晶胞的边长为acm,则有:
,硼原子个数为4个,设晶胞的边长为acm,则有:![]() ,得出:
,得出: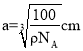 ,两个最近N原子间的距离为面对角线的一半,即
,两个最近N原子间的距离为面对角线的一半,即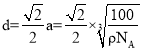 cm,故答案为:4
cm,故答案为:4 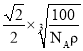
(6)若将A离子移到晶胞的体心,实际上就是将Na+和Cl-的位置对调,即黑子和白子的位置对调,故B离子移到了棱心,故答案为:棱心。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】现使用酸碱中和滴定法测定市售白醋的总酸量 (g/100mL )。
I.实验步骤:
(1)用_____ (填仪器名称 )量取10.00mL 食用白醋,在_____ (填仪器名称 )中用水稀释后转移到100mL_____ (填仪器名称 )中定容,摇匀即得待测白醋溶液。
(2)用_____色手柄滴定管取待测白醋溶液 20.00mL 于锥形瓶中,向其中滴加2滴_____作为指示剂。
(3)读取盛装0.1000mol/L NaOH 溶液的滴定管的初始读数。如果液面位置如图所示 则此时的读数为_____mL。
![]()
(4)滴定。当_____时,停止滴定,并记录 NaOH溶液的终读数,重复滴定 3 次。
II.实验记录
滴定次数 实验数据 (mL ) | 1 | 2 | 3 | 4 |
V (样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
V (NaOH ) (消耗 ) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)甲同学在处理数据时计算得平均消耗的NaOH溶液的体积为:V= (15.95+15.00+15.05+14.95 )/4=15.24(mL)。指出他的计算的不合理之处:_____。 按正确数据处理,可得c (市售白醋)=_____mol/L。
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____ (填写序号)
a.盛装NaOH的滴定管在滴定时未用标准NaOH溶液润洗
b.盛装待测白醋的滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
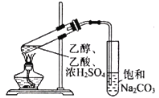
【题目】下列实验中,实验操作、装置、现象及结论都正确的是
选项 | 实验操作或装置 | 实验现象 | 相关解释及结论 |
A. | 用两支试管各取5 mL 0.1 mol·L-1酸性KMnO4溶液,分别加入2 mL 0.1 mol·L-1和0.2 mol·L-1 H2C2O4溶液 | 两试管溶液均褪色,且加0.2 mol·L-1H2C2O4的试管中褪色更快 | 其他条件不变,H2C2O4浓度越大,化学反应速率越大 |
B. |
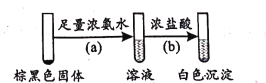
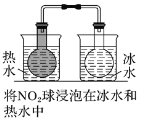
| 左球气体颜色加深,右球气体颜色变浅 | 勒夏特列原理 |
C. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
D. |
| 饱和Na2CO3溶液上有透明的不溶于水的油状液体产生 | 乙酸乙酯难溶于水 |
A.AB.BC.CD.D