题目内容
【题目】在工业上可用含SiO2、CeO2和Fe2O3的废料作原料来获得硫酸铁铵晶体(Fe2(SO4)3·2(NH4)2 SO4·3H2O),同时可回收CeO2,工艺流程设计如下
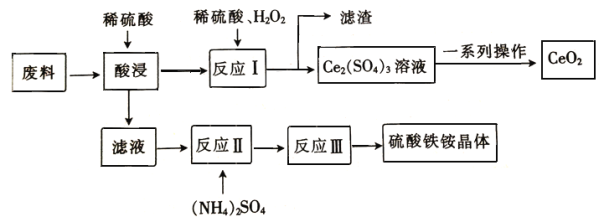
已知: ①SiO2、CeO2不溶于稀硫酸;②酸性条件下,CeO2可与H2O2反应;③“反应Ⅰ”所得溶液中含有Ce3+;④碱性条件下,NH4+与OH-结合生成NH3·H2O。
请回答下列问题
(1)“酸浸”时未发生的反应 物质是__________________(填化学式)。
(2)“滤液”中含有的阳离子有___________________(填离子符号)。
(3)写出“反应Ⅰ”的化学方程式:________________________________________。
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是__________________(填化学式)。
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:_____________________。
【答案】CeO2和SiO2 H+、Fe3+ 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O H2O2 Fe3++2NH4++5OH-=Fe(OH)3↓+2NH3H2O
【解析】
废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)中加入稀硫酸,Fe2O3转化Fe2(SO4)3存在于滤液中,反应Ⅰ中含CeO2和SiO2,向反应Ⅰ加入稀硫酸和H2O2,CeO2转化为Ce3+存在于滤液中,反应为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,滤渣为SiO2,并利用氧气将Ce从+3氧化为+4后Ce (OH)3转化为沉淀Ce(OH)4,反应为:4Ce (OH)3+O2+2H2O═4Ce(OH)4,加入分解Ce(OH)4得到产品CeO2,向滤液Fe2(SO4)3中加入硫酸铵经反应,并蒸发浓缩、常温晾干后得到硫酸铁铵晶体。
(1)“酸浸”时未发生的反应物质是CeO2和SiO2,
故答案为:CeO2和SiO2;
(2)加入稀硫酸,Fe2O3转化Fe2(SO4)3存在于滤液中,故“滤液”中含有的阳离子有H+、Fe3+,
故答案为:H+、Fe3+;
(3)反应Ⅰ是CeO2转化为Ce3+存在于滤液中,反应为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,反应的离子方程式:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,
故答案为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(4)在酸性条件下,发生的反应为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,氧化剂的氧化性强于还原剂,在该反应中Ce从+4降低到+3,化合价降低作氧化剂,H2O2中O从-1价升高到0价,作还原剂,故CeO2氧化性强于H2O2,故氧化性较弱的是H2O2,
故答案为:H2O2;
(5)往硫酸铁铵溶液中加入过量的NaOH,该反应的离子方程式为Fe3++2NH4++5OH-=Fe(OH)3↓+2NH3H2O,
故答案为:Fe3++2NH4++5OH-=Fe(OH)3↓+2NH3H2O。

 阅读快车系列答案
阅读快车系列答案【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
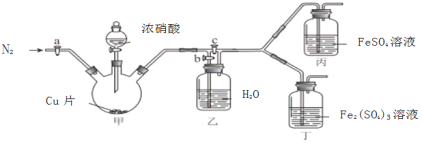
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。
【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
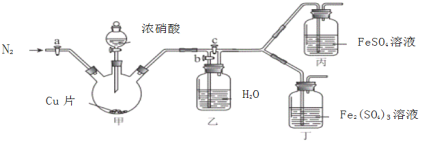
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。