题目内容
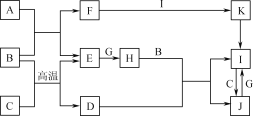
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)⑦的离子结构示意图是__________;
(2)表中最活泼的金属是________(填写元素符号),能形成的最稳定气态氢化物的化学式是_______;
(3)
(4)⑤、⑧形成化合物中含有的化学键是________(填“离子键”或“共价键”);
(5)1mol④的单质与足量②的氢化物完全反应产生的气体在标准状况下的体积为_____;
(6)写出⑥的单质与④的最高价氧化物的水化物溶液反应的化学方程式_____________。
【答案】![]() K HF
K HF ![]() 离子键 11.2L 2 Al + 2NaOH + 2H2O === 2 NaAlO2 + 3H2↑
离子键 11.2L 2 Al + 2NaOH + 2H2O === 2 NaAlO2 + 3H2↑
【解析】
根据周期表分析,①为碳,②为氧,③为氟,④为钠,⑤为镁,⑥为铝,⑦为硫,⑧为氯,⑨为钾。
根据周期表分析,①为碳,②为氧,③为氟,④为钠,⑤为镁,⑥为铝,⑦为硫,⑧为氯,⑨为钾。
(1)⑦为硫,则硫离子结构示意图是![]() ;
;
(2)表中最活泼的金属是钾,能形成的最稳定气态氢化物是氟化氢;
(3)碳的最高价氧化物即二氧化碳的电子式![]() ;
;
(4)氯化镁中含有的化学键是离子键;
(5)1mol钠单质与足量水完全反应产生的0.5mol氢气,在标准状况下的体积为11.2L;
(6)铝和氢氧化钠反应的化学方程式为:2 Al + 2NaOH + 2H2O === 2 NaAlO2 + 3H2↑

【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
查阅资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性Ag+>Cu2+。反应的离子方程式是___________________________________________________。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试 剂 | 编号及现象 | |
试 管 | 滴 管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
①经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
②经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
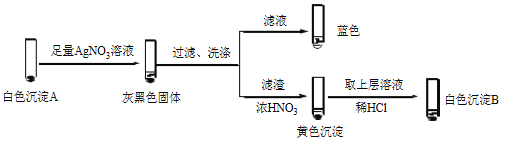
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是___________,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
KI溶液 |
KI溶液 AgNO3溶液 a b |
KI溶液 CuSO4溶液 c d |
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
①a中溶液呈棕黄色的原因是___________________________(用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_____________________________。
③方案2中,Cu2+能氧化I-,而Ag+未能氧化I-。其原因一是从K值______;二是从Cu2+的反应特点______________________________________________。