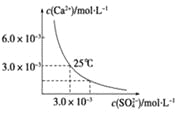
题目内容
【题目】在体积相同的甲、乙两个容器中,分别充有2 mol SO2和1mol O2,在相同的温度下发生反应2SO2+O2![]() 2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
A. 等于p%B. 大于p%C. 小于p%D. 无法判断
【答案】B
【解析】
该反应为气体物质的量减小的反应,若甲容器保持体积不变,乙容器保持压强不变,则随着反应的进行,甲的压强逐渐减小,达平衡时,乙容器压强大于甲容器压强,根据压强对平衡移动的影响分析。
该反应为气体体积减小的反应,甲为恒温恒容容器,乙为恒温恒压容器,乙容器和甲容器相比较,乙容器相当于增大了容器内的压强,增大压强,平衡会向正反应方向(气体体积减小)的方向移动,所以乙容器中SO2的转化率大于甲容器SO2的转化率,反应达平衡后甲容器中SO2的转化率为p%,则乙容器SO2的转化率大于p%,故选B。

 智慧小复习系列答案
智慧小复习系列答案【题目】氨的合成对社会发展与进步有巨大贡献。
(1)某温度下,在容积均为2L的两个密闭容器中分别发生反应。N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0kJ/mol。相关数据如下:
2NH3(g) △H=-92.0kJ/mol。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molN2(g)和3molH2(g) | 2molNH3(g) |
平衡时c(NH3) | c1 | c2 |
平衡时能量变化 | 放出18.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到中平衡状态的是_____(填字母)。
A.3v(N2)正=v(H2)逆 B.N2、H2的浓度之比不再随时间改变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子质量不变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_____ (填字母)。
A.升高温度 B.充入更多的H2 C.移除NH3 D.压缩容器体积
③c1__c2(填“>”“<”或“=”)。
(2)合成氨也可以采用电化学法,其原理如右图所示。则阴极的电极反应式是_________。

(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-906kJ/mol
4NO(g)+6H2O(g) △H=-906kJ/mol
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1267kJ/mol
2N2(g)+6H2O(g) △H=-1267kJ/mol
①该条件下,N2(g)+O2(g)![]() 2NO(g) △H=_____kJ/mol
2NO(g) △H=_____kJ/mol
②为分析催化剂对反应的选择性,在1L密闭容器中充入1molNH3和2molO2,在一定时间内测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应___填“反应I”或“反应II”)。当温度高于840℃时,反应I中NO的物质的量减少的原因是________。520℃时,反应I的平衡常数K=____(只列算式不计算)。
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)⑦的离子结构示意图是__________;
(2)表中最活泼的金属是________(填写元素符号),能形成的最稳定气态氢化物的化学式是_______;
(3)
(4)⑤、⑧形成化合物中含有的化学键是________(填“离子键”或“共价键”);
(5)1mol④的单质与足量②的氢化物完全反应产生的气体在标准状况下的体积为_____;
(6)写出⑥的单质与④的最高价氧化物的水化物溶液反应的化学方程式_____________。
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D