题目内容
【题目】乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1) 室温下,测得 0.1 mol·L1 H2C2O4溶液的pH = 1.3,写出草酸的电离方程式_______。
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
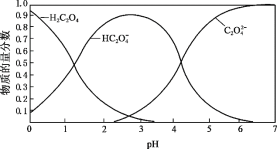
① 向草酸溶液中滴加KOH溶液至pH = 2.5时发生的主要反应的离子方程式是_______。
② 0.1 mol·L1 KHC2O4溶液中,下列粒子浓度关系正确的是_______(填序号)。
a.c(K+) + c(H+) = c(HC2O4–) + c(C2O42–) + c(OH–)
b.c(K+) > c(HC2O4–) > c(C2O42–) > c(H2C2O4)
c.c(K+) = c(HC2O4–) + c(C2O42–) + c(H2C2O4)
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2+ + H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+
① 制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:_____。
② 测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+则FeC2O4·xH2O中x = _______(FeC2O4的摩尔质量是144 g·mol-1)。
【答案】H2C2O4 H+ + HC2O4-,HC2O4- C2O42- + H+ ![]() bc NH3·H2O 与H+反应,降低c(H+)浓度,使Fe2++ H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+ 平衡向正反应方向移动,产生更多的FeC2O4·xH2O 2
bc NH3·H2O 与H+反应,降低c(H+)浓度,使Fe2++ H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+ 平衡向正反应方向移动,产生更多的FeC2O4·xH2O 2
【解析】
(1)测得 0.1 mol·L1 H2C2O4溶液的pH=1.3,说明草酸是二元弱酸;
(2)①向草酸溶液中滴加KOH溶液至pH=2.5,图像可以看出,随着氢氧化钾的加入,HC2O4-的浓度逐渐增大,草酸与氢氧化钾反应后生成HC2O4-和水;
② a. 根据电荷守恒判断;
b.根据溶液中离子的电离和水解情况分析;
c.根据物料守恒判断;
(3)①应用勒夏特列原理,根据离子方程式:Fe2+ + H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+,滴加NH3·H2O 与H+反应,降低c(H+)浓度,使平衡向正反应方向移动,产生更多的FeC2O4·xH2O;
②根据10FeC2O4xH2O+6KMnO4+4H2SO4═5Fe2(SO4)3+2CO2↑+6MnSO4+3K2SO4+(12+x)H2O可知,n(FeC2O4xH2O)=![]() n(KMnO4)=
n(KMnO4)=![]() ×1mol/L×0.018L=0.03mol,则M(FeC2O4xH2O)=
×1mol/L×0.018L=0.03mol,则M(FeC2O4xH2O)=![]() =180g/mol,即FeC2O4xH2O的相对分子质量为180,结合18x+144=180计算出x即可;
=180g/mol,即FeC2O4xH2O的相对分子质量为180,结合18x+144=180计算出x即可;
(1)二元弱酸分步电离,草酸电离方程式为:H2C2O4 H++HC2O4-,HC2O4-C2O42- +H+,
故答案为:H2C2O4 H+ + HC2O4-,HC2O4- C2O42- + H+;
(2) a. 溶液中有的离子:HC2O4-、H2C2O4、C2O42-、OH–、K+,根据电荷守恒c(K+) + c(H+) = c(HC2O4–) +2c(C2O42–) + c(OH–),故a错误;
b. KHC2O4溶液中,HC2O4–要水解,c(K+) > c(HC2O4–) ,C2O42–是由HC2O4–电离后得到的,c(HC2O4–) > c(C2O42–),H2C2O4是由HC2O4–水解后得到的,HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度,可以得到c(C2O42–) > c(H2C2O4),c(K+) > c(HC2O4–) > c(C2O42–) > c(H2C2O4),故b正确;
c. 根据物料守恒,可得到c(K+) = c(HC2O4–) + c(C2O42–) + c(H2C2O4),故c正确;
故答案为b,c;
(3)①应用勒夏特列原理,根据离子方程式:Fe2+ + H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+,滴加NH3·H2O与H+反应,降低c(H+)浓度,使平衡向正反应方向移动,产生更多的FeC2O4·xH2O,
故答案为:NH3·H2O 与H+反应,降低c(H+)浓度,使Fe2++ H2C2O4 + xH2O FeC2O4·xH2O↓ + 2H+平衡向正反应方向移动,产生更多的FeC2O4·xH2O;
②根据10FeC2O4xH2O+6KMnO4+4H2SO4═5Fe2(SO4)3+2CO2↑+6MnSO4+3K2SO4+(12+x)H2O可知,n(FeC2O4xH2O)=![]() n(KMnO4)=
n(KMnO4)=![]() ×1mol/L×0.018L=0.03mol,则M(FeC2O4xH2O)=
×1mol/L×0.018L=0.03mol,则M(FeC2O4xH2O)=![]() =180g/mol,即FeC2O4xH2O的相对分子质量为180,结合18x+144=180,解得x=2;
=180g/mol,即FeC2O4xH2O的相对分子质量为180,结合18x+144=180,解得x=2;
故答案为:2。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案【题目】由下列实验及现象能推出相应结论的是
实验操作及实验现象 | 结 论 | |
A | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应[FeCl3+ 3KSCN |
B | 向做了相同标记的2支试管中均加入2mL 0.1mol/L Na2S2O3溶液,再分别向2支试管中加入4mL浓度为0.1mol/L、0.5mol/L 的H2SO4溶液,测定恰好遮挡全部标记所用时间 | 其他条件一定时,反应物浓度越大,化学反应速率越快 |
C | 室温下,用广泛pH试纸测定0.1 mol/L Na2SO3溶液的pH为10,0.1mol/L NaHSO3溶液的pH为5 | 相同条件下,HSO3-的水解能力强于SO32- |
D | 向2 mL0.1mol/LAgNO3溶液中加入1mL0.1mol/LNaCl溶液,生成白色沉淀,再加入1mL0.1mol/L KI溶液,生成黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4溶液滴定H2C2O4溶液,当_________________时,滴定结束。
④记录数据,重复实验。整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)步骤①需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为______(填名称)。
(2)该反应原理的化学方程式为_________________;
(3)请将步骤③补充完整__________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______________mol/L,x=____________;
(5)若滴定终点读数时俯视KMnO4溶液液面,则x值会__________(填“偏大”、“偏小”或“无影响”)。