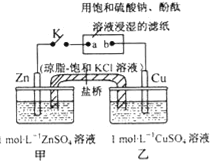
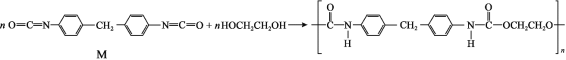
题目内容
【题目】由下列实验及现象能推出相应结论的是
实验操作及实验现象 | 结 论 | |
A | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应[FeCl3+ 3KSCN |
B | 向做了相同标记的2支试管中均加入2mL 0.1mol/L Na2S2O3溶液,再分别向2支试管中加入4mL浓度为0.1mol/L、0.5mol/L 的H2SO4溶液,测定恰好遮挡全部标记所用时间 | 其他条件一定时,反应物浓度越大,化学反应速率越快 |
C | 室温下,用广泛pH试纸测定0.1 mol/L Na2SO3溶液的pH为10,0.1mol/L NaHSO3溶液的pH为5 | 相同条件下,HSO3-的水解能力强于SO32- |
D | 向2 mL0.1mol/LAgNO3溶液中加入1mL0.1mol/LNaCl溶液,生成白色沉淀,再加入1mL0.1mol/L KI溶液,生成黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
【答案】B
【解析】
A. 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅,是因为加入水使溶液变稀了。反应的实质是Fe3++3SCN-Fe(SCN)3,1mL 2mol/L KCl加入对平衡没有影响,故A错误;
B. 相同浓度的Na2S2O3溶液中加入相同体积不同浓度的H2SO4溶液,发现其他条件一定时,反应物浓度越大,化学反应速率越快,故B正确;
C. 室温下,Na2SO3溶液的呈碱性,SO32-水解生成HSO3-和OH-,0.1mol/L NaHSO3溶液的pH为5,呈酸性,HSO3-存在电离平衡和水解平衡,电离程度比水解程度比大,相同条件下,HSO3-的水解能力弱于SO32-,故C错误;
D. 向2 mL0.1mol/LAgNO3溶液中加入1mL0.1mol/LNaCl溶液,生成白色沉淀氯化银,再加入1mL0.1mol/L KI溶液,生成黄色沉淀碘化银,不能实现沉淀的转化,因为硝酸银过量,故D错误;
答案选B。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案