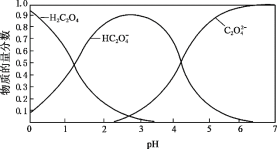
题目内容
【题目】(1)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图。根据题意回答问题:
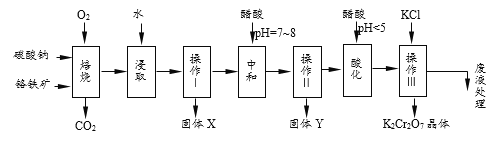
已知:①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑
8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
③Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(2)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。酸化步骤用醋酸调节溶液pH<5,其目的是________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、_______、过滤、_______、干燥。
【答案】Fe2O3、MgO pH计 增大溶液中c(H+),使平衡逆向移动,产生更多的Cr2O72- 冷却结晶 洗涤
【解析】
铬铁矿通过焙烧,发生的反应有4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑、Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2↑、Na2CO3+Al2O3![]() 2NaAlO2+CO2↑,所以得到的固体中含有Na2CrO4、Fe2O3、MgO和NaAlO2,然后加水溶解得固体中含有Fe2O3、MgO和溶液中含有Na2CrO4、NaAlO2,检测酸化操作中溶液的pH是否等于4.5应该使用pH计;调节溶液的pH为小于5,目的是使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,然后将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到K2Cr2O7晶体。
2NaAlO2+CO2↑,所以得到的固体中含有Na2CrO4、Fe2O3、MgO和NaAlO2,然后加水溶解得固体中含有Fe2O3、MgO和溶液中含有Na2CrO4、NaAlO2,检测酸化操作中溶液的pH是否等于4.5应该使用pH计;调节溶液的pH为小于5,目的是使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,然后将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到K2Cr2O7晶体。
(2)通过上述分析可知得到的固体X含有Fe2O3、MgO;
要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计;
在溶液中存在化学平衡:Cr2O72-+H2O![]() 2CrO42-+2H+,向滤液中加入醋酸并调节溶液的pH <5,增大了溶液中c(H+),H+是生成物,增大生成物的浓度,平衡逆向移动,产生更多的Cr2O72-,使溶液中c(Cr2O72-)增大,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7;
2CrO42-+2H+,向滤液中加入醋酸并调节溶液的pH <5,增大了溶液中c(H+),H+是生成物,增大生成物的浓度,平衡逆向移动,产生更多的Cr2O72-,使溶液中c(Cr2O72-)增大,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7;
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案