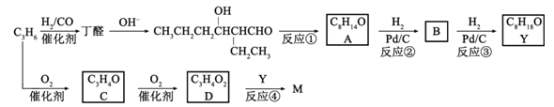
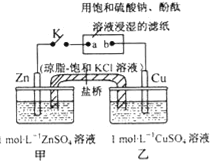
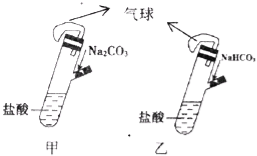
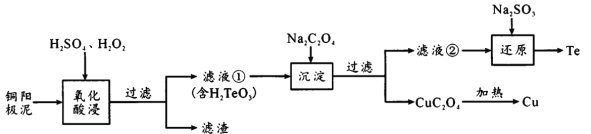
��Ŀ����
����Ŀ���ϳɰ���ҵ������������Ȼ����ˮ������Ӧ�Ʊ�������Ҫ��ӦΪ��
CH4+ 2H2O![]() CO2+4H2����֪��
CO2+4H2����֪��
CH4��g��+2O2��g����CO2��g��+2H2O��l�� ��H=-890kJ/mol
2H2��g��+O2��g����2H2O��l�� ��H=-571.6kJ/mol
H2O��g����H2O��l�� ��H=-44kJ/mol
��1��д������Ȼ����ˮ������Ӧ�Ʊ�H2���Ȼ�ѧ����ʽ��____________��
��2��ij�¶��£�10L�ܱ������г���2mol CH4��3mol H2O��g��������CH4��g��+ 2H2O��g��![]() CO2��g��+4H2��g����Ӧ����һ��ʱ�䷴Ӧ��ƽ�⣬ƽ��ʱ������ѹǿ����ʼʱ��1.4����
CO2��g��+4H2��g����Ӧ����һ��ʱ�䷴Ӧ��ƽ�⣬ƽ��ʱ������ѹǿ����ʼʱ��1.4����
����ƽ��ʱ��CH4��ת����Ϊ__________��H2��Ũ��Ϊ_________����Ӧ���ų�����������_______kJ��
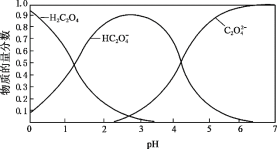
������ƽ����ϵ���¶�,��������ƽ����Է�������___________,�ܶ�_________�����������������С����������������
�����ﵽƽ��ʱ,�������,������ѹǿ����,ƽ�⽫___________�������������������������������ƶ���
�������ֺ��£�������ѹ��Ϊ5L���������Ծ�Ϊ��̬����ƽ�⽫________�������������������������������ƶ����ﵽ��ƽ���,������H2Ũ�ȷ�ΧΪ__________��
���𰸡�CH4��g��+ 2H2O��g��![]() CO2��g��+4H2��g�� ��H=+165.2kJ/mol 50% 0.4mol/L 165.2 ��С ���� ���� ���� 0.4mol/L��c��H2����0.8mol/L
CO2��g��+4H2��g�� ��H=+165.2kJ/mol 50% 0.4mol/L 165.2 ��С ���� ���� ���� 0.4mol/L��c��H2����0.8mol/L
��������
��1����֪����CH4��g��+2O2��g����CO2��g��+2H2O��l�� ��H��-890kJ/mol����2H2��g��+O2��g����2H2O��l����H��-571.6kJ/mol����H2O��g����H2O��l�� ��H��-44kJ/mol������ݸ�˹���ɿ�֪�٣�����2���ۼ��õ���Ȼ����ˮ������Ӧ�Ʊ�H2���Ȼ�ѧ����ʽCH4��g��+ 2H2O��g��![]() CO2��g��+4H2��g�� ��H��+165.2kJ/mol��
CO2��g��+4H2��g�� ��H��+165.2kJ/mol��
��2�� CH4��g��+ 2H2O��g��![]() CO2��g��+4H2��g��
CO2��g��+4H2��g��
��ʼ����mol��2 3 0 0
ת������mol��x 2x x 4x
ƽ������mol��2-x 3��2x x 4x
��2-x+3��2x+x+4x��5��1.4�����x��1��
��ƽ��ʱ��CH4��ת����Ϊ![]() ��100%=50%��H2��Ũ��Ϊ4mol��10L��0.4mol/L����Ӧ����������1mol��165.2kJ/mol��165.2kJ��
��100%=50%��H2��Ũ��Ϊ4mol��10L��0.4mol/L����Ӧ����������1mol��165.2kJ/mol��165.2kJ��
������Ӧ�����ȷ�Ӧ��������ϵ���¶�ƽ��������Ӧ������У���������ʵ������ӣ����������ƽ����Է���������С���ݻ����䣬�ܶȲ��䣻
�۵��ﵽƽ��ʱ���������������ѹǿ���䣬���ݻ������൱�ڼ�Сѹǿ������ƽ�⽫�����ƶ���
�ܱ��ֺ��£�������ѹ��Ϊ5L���������Ծ�Ϊ��̬��������ѹǿ��ƽ�⽫�����ƶ���������������ԭ����֪�ﵽ��ƽ���������H2Ũ�ȷ�ΧΪ0.4mol/L��c��H2����0.8mol/L��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
��1����֪��K300����K350����д���÷�Ӧ��ƽ�ⳣ������ʽ��K=_________________�����ڸ÷�Ӧ������˵���У���ȷ����________��
A����H>0����S>0 B����H>0����S<0
C����H<0����S<0 D����H<0����S>0
��2����ͼ�б�ʾNO2�ı仯��������____________________����O2��ʾ��0-2s�ڸ÷�Ӧ��ƽ������v=_______________��
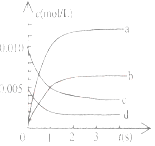
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����__________��
A��v(NO2)=2v(O2) B��������ѹǿ���ֲ���
C��v (NO)=2v��O2�� D���������ܶȱ��ֲ���
��4�����д�ʩ����ʹn(NO2)/n(NO)�������____��(����ĸ)
A�������¶� B���������
C�����ϳ���O2 D������He(g)��ʹ��ϵ��ѹǿ����