题目内容
(1)18gH2O的物质的量是 ,含有 个氢原子(填具体数字);这些H2O与 gOH-所含电子数相等。
(2)标准状况下,①6.72L CH4 ②3.01×1023HCl分子 ③0.2molNH3 ,这三种气体按物质的量由大到 小排列的顺序是(填物质的数字代号,下同) ,按氢原子数由多到少排列的顺序是 ,密度由大到小排列的顺序是 。
(1)1mol(1分); 1.204×1024(1分); 17(1分);
(2)???(1分); ???(1分); ???(1分);
解析试题分析:
(1)18gH2O的物质的量n="m" /M =18g/18g/mol=1mol;1molH2O含有2mol氢原子,即2×NA=1.204×1024个;1molH2O含有10mol电子,含有10mol电子的OH-的物质的量为1mol,1molOH-的质量为17g。
(2):①n(CH4)=6.72L/22.4L/mol=0.3mol,m(CH4)=0.3mol×16g/mol=4.8g,N(H)=4×0.3mol×NA/mol=1.2NA,ρ="M/" Vm ="16/" 22.4g/L;
②n(HCl)="N" /NA =3.01×1023 /6.02×1023/mol=0.5mol,m(HCl)=0.5mol×36.5g/mol=18.25g,N(H)=N(HCl)=0.5NA,ρ="M/" Vm =36.5/22.4g/L;
③m(NH3)=0.2mol×17g/mol=3.4g,N(H)=3×0.2mol×NA/mol=0.6NA,ρ="M" /Vm ="17/" 22.4g/L;
所以:三种气体按质量由大到小排列的顺序是②>①>③;氢原子数由多到少排列的顺序是①>③>②密度由大到小排列的顺序是②>③>①,
考点:阿伏加德罗定律及推论

如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据
回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)在容量瓶的使用方法中,下列操作不正确的是____________(不定项选择)
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。 |
①每位同学各需要量取________mL上述浓盐酸进行配制。(保留小数点后一位)
②在配制过程中,甲同学存在以下不正确操作,对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
③乙同学转移溶液时操作如图所示,其中存在的错误是____________________________________________。
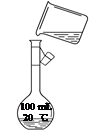

 NaHSO4 + HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应。求:
NaHSO4 + HCl↑,现有117g NaCl晶体和足量的浓硫酸完全反应。求: