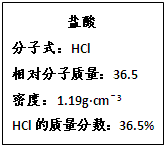
题目内容
元素周期表是学习和研究化学的重要工具。按要求回答下列问题:
A、B、C、D、E是短周期元素,其原子序数依次增大。A、C两元素的最外层只有一个电子,C离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素A可以和B形成A2B和A2B2两种分子;化合物甲和乙的每个分子中均含有5个原子,甲是由元素D与A组成,其分子的核外电子总数为18,乙是由元素D与E组成;化合物丙是由C与E组成的。
(1)元素B、D、E的元素符号依次为_______、_______、______。
(2)上述5种元素形成的分子中,除甲分子外,核外电子总数也为18的有___(填分子式)
(3)D的氧化物在高温下可以与C的碳酸盐发生反应,其化学反应方程式为________;化合物乙遇水剧烈反应有白雾生成,其反应的化学方程式为___________。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的质量为________;配制过程中除用到容量瓶外,还需要的玻璃仪器有___________________。电解所配制的400mL溶液,当电路中通过1mol电子时,理论上可收集到的气体在标准状况下的体积为_________L。
(1)O,Si,Cl(每空1分)
(2)H2O2、HCl(对一个给1分) (3)SiO2+Na2CO3 NaSiO3+CO2↑(缺少条件扣1分);
NaSiO3+CO2↑(缺少条件扣1分);
SiCl4+3H2O=H2SiO3+4HCl↑(或SiCl4+4H2O=H3SiO4+4HCl↑)
(4)29.25g(或29.3g),烧杯、玻璃棒、胶头滴管(少1个扣1分,扣完为止);19.04
解析试题分析:A、B、C、D、E是短周期元素,其原子序数依次增大。A、C两元素的最外层只有一个电子,说明二者是第IA组元素。C离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同。由于非金属性最强的是F,所以C是Na元素。元素A可以和B形成A2B和A2B2两种分子,且B的原子序数小于钠的,因此A和B应该是H和O元素。化合物甲和乙的每个分子中均含有5个原子,甲是由元素D与A组成,其分子的核外电子总数为18,这说明甲是SiH4,所以D是Si元素。乙是由元素D与E组成。由于E的原子序数等于Si的,所以E是氯元素,即乙是SiCl4;化合物丙是由C与E组成的,则丙是NaCl。
(1)元素B、D、E的元素符号依次为O,Si,Cl。
(2)上述5种元素形成的分子中,除甲分子外,核外电子总数也为18的还有H2O2、HCl。
(3)在高温下二氧化硅与碳酸钠反应生成硅酸钠和CO2,反应的化学方程式为SiO2+Na2CO3 NaSiO3+CO2↑。SiCl4遇水剧烈反应有白雾生成,这说明反应中有氯化氢生成。根据原子守恒可知同时还有硅酸生成,则其反应的化学方程式为SiCl4+3H2O=H2SiO3+4HCl↑(或SiCl4+4H2O=H3SiO4+4HCl↑)。
NaSiO3+CO2↑。SiCl4遇水剧烈反应有白雾生成,这说明反应中有氯化氢生成。根据原子守恒可知同时还有硅酸生成,则其反应的化学方程式为SiCl4+3H2O=H2SiO3+4HCl↑(或SiCl4+4H2O=H3SiO4+4HCl↑)。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的质量=0.5L×1mol/L×58.5g/mol=29.25g;配制过程中除用到容量瓶外,还需要的玻璃仪器有烧杯、玻璃棒和胶头滴管。400mL 1mol/L的氯化钠溶液中溶质氯化钠的物质的量=0.4L×1mol/L=0.4mol。电解氯化钠溶液的方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。根据方程式可知,每生成1mol氢气和1mol氯气转移2mol电子,消耗2mol氢氧化钠,因此0.4mol氢氧化钠转移0.4mol。由于电路中通过1mol电子,这说明氢氧化钠不足,生成氢气和氯气的物质的量都是0.2mol。电解的后阶段只电解水,转移0.6mol电子。则根据方程式2H2O
2NaOH+H2↑+Cl2↑。根据方程式可知,每生成1mol氢气和1mol氯气转移2mol电子,消耗2mol氢氧化钠,因此0.4mol氢氧化钠转移0.4mol。由于电路中通过1mol电子,这说明氢氧化钠不足,生成氢气和氯气的物质的量都是0.2mol。电解的后阶段只电解水,转移0.6mol电子。则根据方程式2H2O 2H2↑+O2↑可知,转移0.6mol电子时生成0.3mol氢气和0.15mol氧气,所以理论上可收集到的气体在标准状况下的体积为(0.2mol+0.2mol+0.3mol+0.15mol)×22.4L/mol=19.04L。
2H2↑+O2↑可知,转移0.6mol电子时生成0.3mol氢气和0.15mol氧气,所以理论上可收集到的气体在标准状况下的体积为(0.2mol+0.2mol+0.3mol+0.15mol)×22.4L/mol=19.04L。
考点:考查元素推断、18电子微粒、碳酸钠与二氧化硅、四氯化硅的水解反应;氯化钠的配制以及电解氯化钠溶液的有关计算