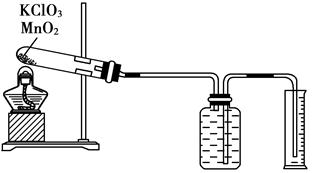
题目内容
(1)8 g CH4的物质的量为 ,在标准状况下所占的体积约为 ;
(2)100mL 1 mol·L-1Al2(SO4)3溶液中含Al3+离子 mol,含SO42-离子 个。
(3)0.6mol O2与0.4mol O3质量之比为 ,分子个数之比为 ,原子个数之比 ,它们在同温同压下的体积比是 。
(每空2分,共8分)(1)0.5mol;11.2L (2)0.2;1.806X1023个 (3)1:1;3:2;1:1;3:2
解析试题分析:(1)甲烷的摩尔质量是16g/mol,则根据n= 可知,8 g CH4的物质的量=8g÷16g/mol=0.5mol;标准状况下气体的摩尔体积是22.4L/mol,则根据n=
可知,8 g CH4的物质的量=8g÷16g/mol=0.5mol;标准状况下气体的摩尔体积是22.4L/mol,则根据n=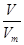 可知,在标准状况下所占的体积约为0.5mol×22.4L/mol=11.2L。
可知,在标准状况下所占的体积约为0.5mol×22.4L/mol=11.2L。
(2)100mL 1 mol·L-1Al2(SO4)3溶液中硫酸铝的物质的量=0.1L×1mol/L=0.1mol,则根据Al2(SO4)3=2Al3++3SO42-可知,溶液中含Al3+离子的物质的量=0.1mol×2=0.2mol。溶液中含SO42-离子的物质的量=0.1mol×3=0.3mol,则个数=0.3mol×6.02X1023/mol=1.806X1023个。
(3)氧气和臭氧的相对分子质量分别是32和48,则根据n= 可知,0.6mol O2与0.4mol O3质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1;根据N=nNA可知,分子个数之比为0.6mol:0.4mol=3:2;原子个数之比=0.6mol×2:0.4mol×3=1:1;根据n=
可知,0.6mol O2与0.4mol O3质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1;根据N=nNA可知,分子个数之比为0.6mol:0.4mol=3:2;原子个数之比=0.6mol×2:0.4mol×3=1:1;根据n=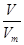 可知,它们在同温同压下的体积比=0.6mol:0.4mol=3:2。
可知,它们在同温同压下的体积比=0.6mol:0.4mol=3:2。
考点:考查物质的量、微粒数、气体体积以及物质的量浓度的有关计算

下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
| 实验次数 | 称取样品的 质量/g | 所加Ba(OH)2 溶液的体积/L | 测得生成沉淀 的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
分析上表数据回答下列问题:
(1)第2次实验中产生沉淀多少克?请将结果填在表格相应空格中。
(2)样品中KHCO3和Na2CO3的物质的量之比是 。
(3)室温下,取上述Ba(OH)2溶液50 mL,加入0.05 mol·L-1的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程)。