题目内容
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
(1)一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为______。
(2)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是______(填编号)。
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu d.溶液中有Fe2+,不溶物为Cu、Al
(3)将一定质量的铁、铝、铜合金,加入lL一定物质的量浓度的硝酸中,合金完全溶解,测得溶液中(忽略溶液体积的变化)c(H+)=0.5mol/L、c(Cu2+)=0.3mol/L、c(Al3+)=0.2mol/L、c(NO3-)=2mol/L,则混合物中铁的质量为______。
(4)铁的某种氧化物的化学式表示为FexO(x<1),已知铁元素在该氧化物中的质量分数为75%,则x=______ (精确至0.01)。
(5)Na-AI/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变。
①若该正极的电极反应式表示为:2Na++FeS+2e-=Na2S+Fe,则电池的负极反应式可表示为_____;充电时,阳极发生反应的物质是______。
②用该电池作电源,组成如图所示装置,若通电5min时,铜电极质量增加1.08 g,则该电源电极X名称为______。图中装置A、C的pH变化为:A ______、C ______(填“增大”“减小”或“不变”)。
(14分)(1) 6.02×1022 或0.1NA(1分)(2) a b(1分)(3)5.6g(2分)
(4)0.86 (2分) (5)①2 Na-2e-=2Na +(1分) Na 2S、Fe(1分)
②负极(2分) 增大(2分) 不变(2分)
解析试题分析:(1)钠在反应中只能失去1个电子,所以2.3g的Na完全与O2反应生成3.6g产物时失去的电子的物质的量是2.3g÷23g/mol=0.1mol,电子个数是6.02×1022 或0.1NA。
(2)铝和铁都能把位于其后的金属从其盐溶液中置换出来,但铝的活泼性强于铁,铝先与氯化铜溶液反应。a.铝粉、铁粉如果都全部与氯化铜溶液反应,且氯化铜过量,溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu,故a正确;b.铝粉全部与氯化铜溶液反应、铁粉部分与氯化铜溶液未反应,溶液中有Fe2+、Al3+,不溶物为Cu、Fe,故b正确;c.铁粉与氯化铜溶液反应生成氯化亚铁和铜,不可能生成Fe3+,故c错误;d.铝先与氯化铜溶液反应,然后铁与氯化铜溶液反应,只要铝剩余,铁与氯化铜溶液就不反应,溶液中就不可能含有Fe2+,故d错误,答案选ab。
(3)溶液中含有硝酸,所以铁以Fe3+的形式存在。根据电荷守恒可知c(H+)+2c(Cu2+)+3c(Al3+)+3c(Fe3+)=c(NO3-),即0.5mol/L+0.3mol/L×2+0.2mol/L×3+3c(Fe3+)=2mol/L,解得c(Fe3+)=0.1mol/L。根据铁原子守恒可知,铁的物质的量等于铁离子的物质的量,即等于0.1mol/L×1L=0.1mol,质量为0.1mol×56g/mol=5.6克。
(4)铁元素在该氧化物中的质量分数为75%,则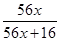 =0.75,解得x=0.86。
=0.75,解得x=0.86。
(5)①原电池中负极失去电子,发生氧化反应。Na和Al都属于金属,但Na较Al活泼,所以根据正极反应式和原电池的电极材料Na-Al/FeS可知负极材料为Na,电极发生反应为2Na-2e-=2Na+;又知该电池中正极的电极反应式为2Na++FeS+2e-=Na2S+Fe,所以电池反应为:2Na+FeS=Na2S+Fe。充电时为电解池原理,相当于原电池的逆反应,因此阳极电极反应式为Na2S+Fe-2e-=2Na++FeS,所以充电时,阳极发生反应的物质是Na 2S和Fe。
②通电5min时,铜电极质量增加1.08 g,这说明铜电极是阴极,与电源的负极相连,即X是电源的负极,Y是正极。A是惰性电极电解氯化钾溶液,生成物是氯气、氢气和氢氧化钾,溶液pH增大。C相当于是在铜上镀银,属于待镀,因此溶液的pH不变。
考点:考查氧化还原反应的有关判断、计算;铁氧化物化学式的计算;电化学原理的有关应用和计算等

某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的两种或多种。取该溶液100mL,加入过量NaOH溶液,加热,得到448mL(标况)气体,同时产生红褐色沉淀,经过滤、洗涤、灼烧,得到1.6g固体;将上述滤液平均分成两份,一份中加足量BaCl2溶液,得到2.33g不溶于盐酸的沉淀;另一份中通入过量CO2得到1.56g白色沉淀。由此可推断原溶液一定含有的离子种类及其浓度,将结果填入下表(可不填满)。
| 一定含有的离子种类 | | | | | | | |
| 物质的量浓度(mol/L) | | | | | | | |
下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
| 实验次数 | 称取样品的 质量/g | 所加Ba(OH)2 溶液的体积/L | 测得生成沉淀 的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
分析上表数据回答下列问题:
(1)第2次实验中产生沉淀多少克?请将结果填在表格相应空格中。
(2)样品中KHCO3和Na2CO3的物质的量之比是 。
(3)室温下,取上述Ba(OH)2溶液50 mL,加入0.05 mol·L-1的盐酸,反应后所得溶液的pH=2,求所加盐酸的体积(混合时不考虑溶液体积变化,写出计算过程)。