题目内容
1.下列关系式或离子方程式中,正确的是( )| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+NH3•H2O+2BaSO4↓ | |
| B. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) |
分析 A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:2,铵根离子结合氢氧根离子能力大于氢氧化铝,所以氢氧化铝不会溶解;
B.根据硫化钠溶液中的质子守恒判断;
C.根据醋酸的电离平衡常数可知:$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{{K}_{a}}{c({H}^{+})}$,据此判断稀释后该比值的变化;
D.HA若为弱酸,则反应后生成强碱弱酸盐,溶液显示碱性,则c(Na+)>c(A-)、c(OH-)>c(H+).
解答 解:A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,反应生成氢氧化铝沉淀、一水合氨和硫酸钡,正确的离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故A错误;
B.常温下,0.1 mol•L-1Na2S溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),故B错误;
C.常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,稀释过程中醋酸的电离平衡常数不变,氢离子浓度减小为原来的$\frac{1}{10}$,结合醋酸的电离平衡常数可知,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{{K}_{a}}{c({H}^{+})}$,故该比值变为原来的10倍,故C正确;
D.当HA为弱酸时,反应生成强碱弱酸盐NaA,溶液呈碱性,则:c(Na+)>c(A-)、c(OH-)>c(H+),则溶液中离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较、离子方程式的书写、弱电解质的电离及其影响等知识,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力,注意掌握电荷守恒、物料守恒、质子守恒及盐的水解原理在判断离子浓度大小中的应用.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
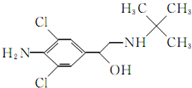 食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )| A. | 化学式为C12H18ONCl2 | |
| B. | 遇FeCl3溶液发生显色反应 | |
| C. | 属于芳香族化合物 | |
| D. | 可以发生取代、加成、水解、酯化、消去反应 |
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | 稳定性:H2Se>AsH3 |
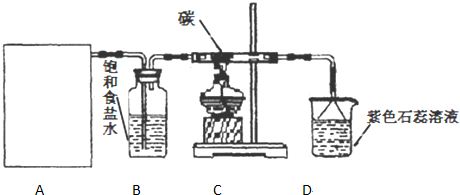
| A. | 为了加快反应速率可用饱和食盐水代替水反应 | |
| B. | 此反应是放热反应 | |
| C. | 反应中不需加碎瓷片作沸石 | |
| D. | 为了除去杂质气体,除了用硫酸铜外还可用氢氧化钠溶液 |
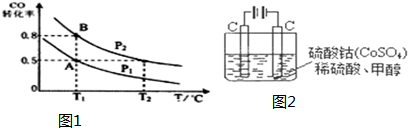
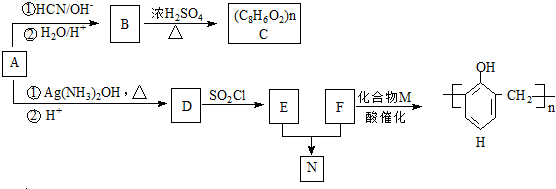
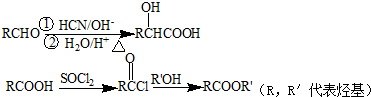 (R,R′代表烃基)
(R,R′代表烃基)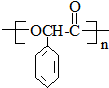 ,M的结构式
,M的结构式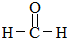 .
. .
.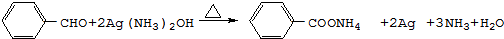 .
.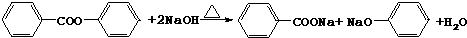 .
.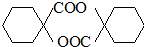 ,其它无机试剂任选.
,其它无机试剂任选.