题目内容
16.由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质.
(1)人们可以在周期表里金属和非金属的交界处找到半导体材料.
①下列单质中,只有一种物质不能做半导体材料,该物质是C
A.Si B.Ge C.S
②Ga和As可以形成一种新型化合物半导体材料,其性能比硅更优越.Ga位于周期表的第ⅢA族,As位于周期表的第VA族.这种的新型化合物化学式为GaAs;
(2)致冷剂应该低毒、不易燃烧,性质稳定.致冷剂氟利昂(CF2Cl2)是科学家求助于周期表中元素及其化合物的易燃性、毒性、沸点等方面的变化趋势开发出来的.
①氢化物的易燃性:
第二周期CH4>NH3>H2O;第三周期SiH4>PH3>H2S>HCl.
②化合物的毒性:
PH3>NH3 H2S>H2O CS2>CO2 CCl4>CF4
于是科学家们开始把注意力集中在含F、Cl的化合物上.经过较长时间反复试验,一种新的致冷剂氟里昂(CF2Cl2)终于诞生了.尽管现在我们知道,氟里昂导致了臭氧层的破坏,但科学家的这种研究思路还是值得肯定的.
分析 (1)①根据元素在周期表中的位置判断;
②主族元素的最高正价=族序数,负价的绝对值与最高正价之和为8,据此判断化合价再写出化学式;
(2)①元素的非金属性越强,其氢化物越稳定;
②根据N、P氢化物的毒性变化规律分析.
解答 解:(1)①在周期表里金属和非金属的交界处找到半导体材料,Si和Ge在金属和非金属的交界处可以作半导体,S是非金属性较强的元素,不能作半导体;
故答案为:C;
②主族元素的最高正价=族序数,负价的绝对值与最高正价之和为8,Ga位于周期表的第ⅢA族其最高正价为+3价,As位于周期表的第VA族,负价为-3价,则二者形成的化合物为GaAs;
故答案为:GaAs;
(2)①元素的非金属性越强,其氢化物越稳定,非金属性:C<N,则稳定性:CH4<NH3,所以易燃性:CH4>NH3,故答案为:>;
②由“毒性:PH3>NH3,”可知:同主族元素的化合物的毒性从上到下逐渐增大.故答案为:>.
点评 本题考查物质的性质在周期表中的递变规律,为高频考点,题目难度中等,解答本题时,注意根据题中信息,找出相对应的递变规律.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
6.下列晶体属于分子晶体的是( )
| A. | 石英 | B. | C60 | C. | NaCl | D. | 金属K |
4.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 常温常压下,17g NH3所含的原子数目为4NA | |
| C. | 铝与足量盐酸反应,生成2.24L H2时,转移的电子数为0.2NA | |
| D. | 0.1mol/L Na2CO3溶液中含有的Na+数目为0.2NA |
11.下列各组元素中,属于同一周期的是( )
| A. | Na、Li | B. | N、Cl | C. | Si、S | D. | O、P |
1.下列关系式或离子方程式中,正确的是( )
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+NH3•H2O+2BaSO4↓ | |
| B. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) |
8.下列石油和煤的炼制和加工过程中,不属于化学变化的是( )
| A. | 分馏 | B. | 干馏 | C. | 裂化 | D. | 裂解 |
5.下列卤代烃能发生消去反应的是( )
| A. | CH3Br | B. | 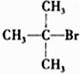 | C. | 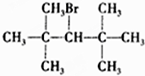 | D. | 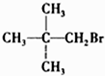 |
6.在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数;这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A. | 原子序数:Z>Y>X>W | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | X元素最高价氧化物对应水化物的化学式为:H2XO3 | |
| D. | 四种元素的气态氢化物中,W的气态氢化物最稳定 |