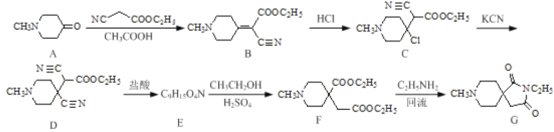
��Ŀ����
����Ŀ����1����ͼ�ĵ�ѭ������̬ϵͳ����ѭ������Ҫ���֣������Ӿ��˵�ѭ���е�����ת����
������˵����ȷ����_______������ĸ��ţ�
A.�̵������У�N2ֻ��������
B.����������Ҫ������������
C.�����������������ֲ��˹��̵��Ե�ѭ����ɵ�Ӱ��
D.ͬ�������������У�ʵ���˵�Ԫ����������л���֮���ת��
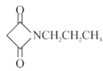
�ڷ����������У�CH3OH����Ϊ��Ӧ�Ļ�ԭ����1mol��ԭ��ʧȥ6mol���ӡ��뽫�÷�Ӧ�����ӷ���ʽ����������5CH3OH+��NO3��![]() ��_______+��_______+��_______+��_______��_____________
��_______+��_______+��_______+��_______��_____________
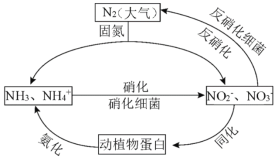
��2���о��������������NOx���Ͷ���������������������γ��йء�
����֪��SO2����SO3�ܷ�Ӧ����ʽ��2SO2(g)��O2(g)![]() 2SO3(g)��H����196.6kJ/mol
2SO3(g)��H����196.6kJ/mol
�˷�Ӧ��ͨ������������ɣ�2NO(g)��O2(g)![]() 2NO2(g)��H1����113kJ/mol
2NO2(g)��H1����113kJ/mol
NO2(g)��SO2(g)![]() SO3(g)��NO(g)��H2��_______��
SO3(g)��NO(g)��H2��_______��
��һ���¶��£���2L�����ܱ������г���NO2��SO2��1mol��5min�ﵽƽ�⣬��ʱ������NO2��NO��Ũ��֮��Ϊ1��3����NO2��ƽ��ת������_______��
��3���飨As���ǵ������ڢ�A��Ԫ�أ��仯������Ź㷺����;��
��AsH3���ȶ��Ա�NH3���ȶ���_______������ǿ��������������������ԭ�ӽṹ����ԭ��_______��
�ڳ��������������Ҫ�ɷ�ΪAs2S3���Ƴɽ�״��ͨ��O2����������H3AsO4�͵�����д��������Ӧ�Ļ�ѧ����ʽ_______��
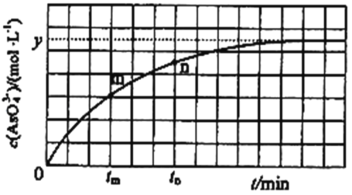
��298Kʱ����20mL3xmolL-1Na3AsO3��20mL3xmolL-1I2��20mLNaOH��Һ��ϣ�������Ӧ��AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)����Һ��c(AsO43��)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ_______��
AsO43-(aq)+2I-(aq)+H2O(l)����Һ��c(AsO43��)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ_______��
���𰸡�BCD 5CH3OH+6NO3-![]() N2��+4HCO3-+CO32-+8H2O ��41.8kJ/mol 75% �� N��Asλ��ͬһ���壬As�ĵ��Ӳ�����N�Ķ࣬ԭ�Ӱ뾶As��N�Ĵõ�������As��N�����ǽ�����As��N�����⻯��AsH3���ȶ��Ա�NH3�� 2As2S3+5O2+6H2O=4H3AsO4+6S
N2��+4HCO3-+CO32-+8H2O ��41.8kJ/mol 75% �� N��Asλ��ͬһ���壬As�ĵ��Ӳ�����N�Ķ࣬ԭ�Ӱ뾶As��N�Ĵõ�������As��N�����ǽ�����As��N�����⻯��AsH3���ȶ��Ա�NH3�� 2As2S3+5O2+6H2O=4H3AsO4+6S ![]()
��������
��1����A�������ڴ���������Ϊ����������ӡ���������ӣ�N�Ļ��ϼ����ߣ�������������N2����ԭ������A����
B��NH3ת����HNO2��������OԪ�أ���NH3����������������������ϸ�������·���������������Ҫ�����������룬��B��ȷ��
C�����������̣����ɵ�����������ṩ�������������������������ֲ��˹��̵��Ե�ѭ����ɵ�Ӱ�죬��C��ȷ��
D�����������Ƕ�ֲ�ﵰ��ת��Ϊ������笠����ӣ����л���ת��Ϊ���ͬ�������������У�ʵ���˵�Ԫ����������л���֮���ת������D��ȷ��
��ѡBCD��
�ڷ����������У�CH3OH����Ϊ��Ӧ�Ļ�ԭ����1mol��ԭ��ʧȥ6mol���ӡ�CH3OH����������ӷ�Ӧ���ɵ�����̼������ӡ�̼��������Ӻ�ˮ����Ӧ�����ӷ���ʽΪ��5CH3OH+6NO3-![]() N2��+4HCO3-+CO32-+8H2O���ʴ�Ϊ��5CH3OH+6NO3-
N2��+4HCO3-+CO32-+8H2O���ʴ�Ϊ��5CH3OH+6NO3-![]() N2��+4HCO3-+CO32-+8H2O��
N2��+4HCO3-+CO32-+8H2O��
��2���٢�.2SO2(g)��O2(g)![]() 2SO3(g)��H����196.6kJ��mol��1
2SO3(g)��H����196.6kJ��mol��1
��.2NO(g)��O2(g)![]() 2NO2(g)��H1����113kJ��mol��1
2NO2(g)��H1����113kJ��mol��1
��˹���ɼ��㣨��-����![]() �õ�NO2(g)��SO2(g)
�õ�NO2(g)��SO2(g)![]() SO3(g)��NO(g)��H2��-41.8 kJ��mol��1���ʴ�Ϊ��-41.8 kJ��mol��1��
SO3(g)��NO(g)��H2��-41.8 kJ��mol��1���ʴ�Ϊ��-41.8 kJ��mol��1��
��һ���¶��£���2 L�����ܱ������г���NO2��SO2��1 mol��5min�ﵽƽ�⣬��ʱ������NO2��NO��Ũ��֮��Ϊ1��3��������м�����ʽ�õ���������NO2�����ʵ���Ϊx��
NO2��NO��Ũ��֮��Ϊ1��3�����ʵ���֮��=1��3����1-x����x=1��3��x=0.75mol��NO2��ƽ��ת����=![]() ��100%=75%��
��100%=75%��
�ʴ�Ϊ��75%��
��3���ٷǽ����ԣ�N>As��AsH3���ȶ��Ա�NH3���ȶ���������ԭ�ӽṹ����ԭ��N��Asλ��ͬһ���壬As�ĵ��Ӳ�����N�Ķ࣬ԭ�Ӱ뾶As��N�Ĵõ�������As��N�����ǽ�����As��N�����⻯��AsH3���ȶ��Ա�NH3����
�ڳ��������������Ҫ�ɷ�ΪAs2S3���Ƴɽ�״��ͨ��O2����������H3AsO4�͵�����ϵ���ת����ƽ�÷���ʽΪ��2As2S3+5O2+6H2O=4H3AsO4+6S��
�ʴ�Ϊ��2As2S3+5O2+6H2O=4H3AsO4+6S��
��������ʽ���£�
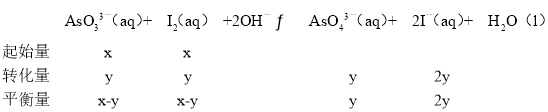
����ƽ�ⳣ������ʽK=![]() =
=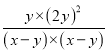 =
=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

����Ŀ����ΪԪ�����ڱ���һ���֣���ش��й����⣺
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | ||
4 | �� |
(1)��������õĽ�����___________���ǽ�������ǿ��Ԫ����____________������дԪ�ط��ţ���ͬ��
(2)�������γ��������������Ԫ����_______________���ֱ�д����Ԫ�ص�����������ޡ�������������Ӧˮ���ﷴӦ�Ļ�ѧ����ʽ��___________��___________��
(3)������������Ӧˮ����ĵ���ʽ______________��
(4)������ͼװ������֤ͬ����Ԫ�طǽ����Եı仯���ɣ�
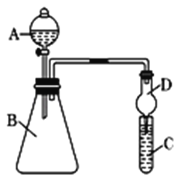
Ҫ֤���ǽ����ԣ�C��Si����A�м����ᣬB�м�CaCO3��C�м�Na2SiO3��Һ��Ӧ��B��D֮������һ��ʢ������____��ѡ��������ĸ��A Ũ���� ��B ŨNaOH��Һ��C ����Na2CO3��Һ ��D ����NaHCO3��Һ����ϴ��װ�ã��Ľ���C�з�����Ӧ�Ļ�ѧ����ʽ��_____��