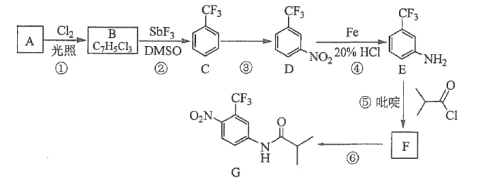
题目内容
【题目】表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)表中最活泼的金属是___________,非金属性最强的元素是____________。(填写元素符号,下同)
(2)表中能形成两性氢氧化物的元素是_______________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物对应水化物反应的化学方程式:___________、___________。
(3)⑨最高价氧化物对应水化物的电子式______________。
(4)利用下图装置来验证同主族元素非金属性的变化规律:
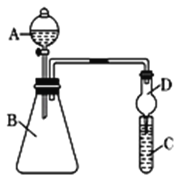
要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量____(选填下列字母:A 浓盐酸 、B 浓NaOH溶液、C 饱和Na2CO3溶液 、D 饱和NaHCO3溶液)的洗气装置.改进后C中发生反应的化学方程式是_____.
【答案】K F Al 2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O Al(OH)3+KOH═KAlO2+2H2O; ![]() D Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3
D Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3
【解析】
本题是对元素周期表和元素周期律的综合考查。根据各元素在表中的位置可知①‐⑨分别为:C、F、Mg、Al、Si、S、Cl、Ar、K,金属性最强的元素位于左下角,非金属性最强的元素位于右上角,非金属性的强弱可通过最高价含氧酸的酸性比较,利用强制弱的原理,通过实验验证。
(1)根据各元素位置,⑨位于左下角,②位于右上角,故最活泼的金属是K,非金属性最强的是F;
(2)能形成两性氢氧化物的元素是Al,其氢氧化物为Al(OH)3,⑥、⑨最高价氧化物对应水化物分别为H2SO4、KOH,反应的化学方程式分别为:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O、Al(OH)3+KOH═KAlO2+2H2O;
(3)⑨最高价氧化物对应水化物为KOH,其电子式![]() ;
;
(4)要证明非金属性:C>Si,可通过比较酸性H2CO3>H2SiO3,利用强酸制弱酸的原理进行验证,如图B中产生的CO2通入C中,Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3,得到H2SiO3白色沉淀,结论得到验证,但由于盐酸具有挥发性,可能通过导管进入C中,干扰实验,故需除去HCl,最合适的试剂为饱和NaHCO3溶液,选D。

 口算能手系列答案
口算能手系列答案