��Ŀ����
����Ŀ���ϳ�ҩ������������ͪ���м���E��˫��A�;�̼����H��·�ߣ�
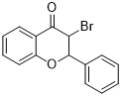
��֪��i.![]()
ii.![]()
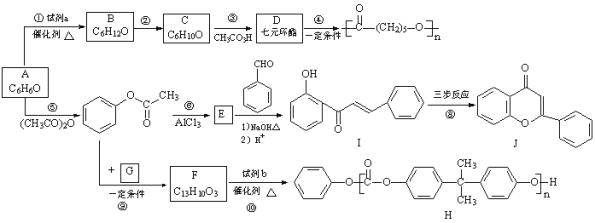
��1��A�Ľṹ��ʽ��__________��
��2���Լ�a��__________��
��3��Cֻ����һ�ֹ����ţ���Ӧ�ڵĻ�ѧ����ʽ��__________��
��4����Ӧ�ݵķ�Ӧ������__________��
��5��E�������__________��
��6������˵����ȷ���ǣ�__________������ĸ��ţ���
a����Ӧ����C����������Ӧ
b������FeCl3��Һ���鷴Ӧ����A�Ƿ�Ӧ��ȫ
c����Ӧ�ķ�Ӧ���������ﻥΪͬ���칹��
d����Ӧ�����Լ�b�Ľṹ��ʽ��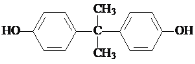
e����Ӧ�������ϾۺϷ�Ӧ�������˾���
��7��I��Jת����һ��·����ͼ����֪�м����2ת��ΪJ����ȥ��Ӧ��д���м����1���м����2�Ľṹ��ʽ��
![]()
����1��__________������2��__________��
��8��G�ķ���ʽΪC3H6O3��ֻ��һ�ֹ����ţ��Һ˴Ź�������ֻ��һ�ֻ�ѧ�������⣬��Ӧ��Ļ�ѧ����ʽ��__________��
���𰸡�![]() H2
H2 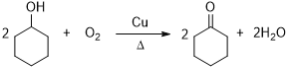 ȡ����Ӧ �ǻ����ʻ� abcd
ȡ����Ӧ �ǻ����ʻ� abcd 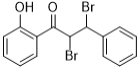
![]()
��������
���ݢݲ���ṹ��ʽ��A����ʽ֪��AΪ![]() ����Ϊȡ����Ӧ����Ϊ�ӳɷ�Ӧ��aΪH2��BΪ
����Ϊȡ����Ӧ����Ϊ�ӳɷ�Ӧ��aΪH2��BΪ![]() ����Ϊ����������CΪ
����Ϊ����������CΪ![]() ��DӦΪ
��DӦΪ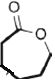 ���������Ϣ���I�Ľṹ��ʽ��֪EΪ
���������Ϣ���I�Ľṹ��ʽ��֪EΪ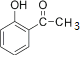 �������ǻ����ʻ���G�ķ���ʽΪC3H6O3��ֻ��һ�ֹ����ţ��Һ˴Ź�������ֻ��һ�ֻ�ѧ�������⣬ӦΪ
�������ǻ����ʻ���G�ķ���ʽΪC3H6O3��ֻ��һ�ֹ����ţ��Һ˴Ź�������ֻ��һ�ֻ�ѧ�������⣬ӦΪ![]() ���������Ϣ��֪FΪ
���������Ϣ��֪FΪ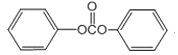 ��
��
��1��A�Ľṹ��ʽ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ;
;
��2��A�������������ӳɷ�Ӧ����B���ʴ�Ϊ��H2��
��3��Cֻ����һ�ֹ����ţ�Ϊ������![]() ����Ӧ�ڵĻ�ѧ����ʽ��:
����Ӧ�ڵĻ�ѧ����ʽ��: ��
��
��4����Ӧ�ݵķ�Ӧ������ȡ����Ӧ���ʴ�Ϊ��ȡ����Ӧ��
��5���ṹ��ʽ��֪EΪ �������ǻ����ʻ����ʴ�Ϊ���ǻ����ʻ���
�������ǻ����ʻ����ʴ�Ϊ���ǻ����ʻ���
��6��a��C��������ﷴӦ������Ԫ����������C����������Ӧ����a��ȷ��
b��A![]() ����FeCl3��Һ������ɫ��Ӧ������FeCl3��Һ���鷴Ӧ����A�Ƿ�Ӧ��ȫ����B��ȷ��
����FeCl3��Һ������ɫ��Ӧ������FeCl3��Һ���鷴Ӧ����A�Ƿ�Ӧ��ȫ����B��ȷ��
c��EΪ ����Ӧ�ķ�Ӧ���������ﻥΪͬ���칹�壬��c��ȷ��
����Ӧ�ķ�Ӧ���������ﻥΪͬ���칹�壬��c��ȷ��
d���Ա�F�Ľṹ��ʽ����Ӧ�����Լ�b�Ľṹ��ʽ��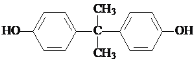 ����d��ȷ��
����d��ȷ��
e����Ӧ�������˾�����û��С�������ɣ��������ϾۺϷ�Ӧ����e����
�ʴ�Ϊ��abcd��
��7��I����̼̼˫���������巢���ӳɷ�Ӧ�����м����1�� ����ȥHBr�����м����2
����ȥHBr�����м����2 ������ȥHBr������J��
������ȥHBr������J��
�ʴ�Ϊ��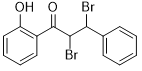 ��
�� ��
��
��8��G�ķ���ʽΪC3H6O3��ֻ��һ�ֹ����ţ��Һ˴Ź�������ֻ��һ�ֻ�ѧ�������⣬��Ӧ��Ļ�ѧ����ʽ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ�~����Ԫ�أ��ش��������⣺
�������� | I A | II A | III A | IV A | V A | VI A | VII A | 0�� |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
4 | �� | �� |
(1)Ԫ�آٵ�������______��Ԫ�آ������ڱ�������λ��________��
(2)Ԫ�آڵļ��⻯��ĽṹʽΪ________��
(3)�õ���ʽ��ʾԪ�آ���ߵĻ�������γɹ��̣�__________________��
(4)��ʾ����ᰴԭ�Ӹ�����1:1�γɵĻ�����ĵ���ʽ��______���û������к��еĻ�ѧ��������______��
(6)�ܡ��ޡ��ߡ�������Ԫ���γɵļ����ӣ����Ӱ뾶�ɴ�С��˳����_____(�������ӷ��ű�ʾ)��
����Ŀ���ԷϾ�п�̵�س���������ѡ���ĺ��̷��ϣ�MnO2��MnOOH��MnO������Fe��Pb�ȣ�Ϊԭ���Ʊ��ߴ�MnCl2��xH2O��ʵ���̵��������á��乤�����̣�
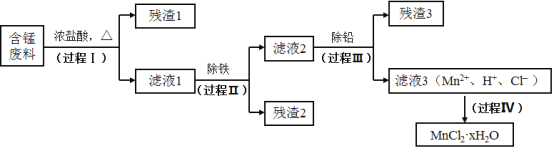
����a��Mn�Ľ������ǿ��Fe��Mn2+�����������±Ƚ��ȶ���pH����5.5ʱ�ױ�O2������
����b�������������������pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
��ʼ����ʱ | 8.1 | 6.5 | 1.9 |
��ȫ����ʱ | 10.1 | 8.5 | 3.2 |
ע���������ӵ���ʼŨ��Ϊ0.1mol��L-1
��1�����̢��Ŀ���ǽ����̡���������Һ1�к��е�������ΪMn2+��Fe3+��Pb2+��H+��
��MnO2��Ũ���ᷴӦ�����ӷ���ʽ��_____________��
�ڼ�����Һ1��ֻ��Fe3+����Fe2+�IJ����������ǣ�ȡ������Һ1���Թ��У��������軯����Һ������ɫ�������ɣ���ȡ������Һ1���Թ��У�_____________��
��Fe3+��Fe2+ת�����ɣ����ܷ����ķ�Ӧ�У�
a��2Fe2++Cl2=2Fe3++2Cl��
b��4Fe2++O2+4H+=2Fe3++2H2O
c��......
д��c�����ӷ���ʽ��_____________��
��2�����̢��Ŀ���dz��������������ַ�����
��.��ˮ��������Һ1��ϡ�ͣ��ټ�����10%�İ�ˮ�����ˡ�
��.���շ�������Һ1Ũ���õ��Ĺ�����290�決�գ���ȴ��ȡ������......��
��֪�������з�������Ҫ��ӦΪ2FeCl3+3O2=2Fe2O3+3Cl2��MnCl2��PbCl2�������仯��
�ٰ�ˮ������ʱ����ҺpHӦ������_____________֮�䡣
�ڲ�ȫ���еIJ�����_____________��
�����ַ����Ƚϣ���ˮ��������ȱ����_____________��
��3�����̢��Ŀ���dz�Ǧ��������Լ���_____________��
��4�����̢����ù����е�x�IJⶨ���£�ȡm1g��Ʒ�����ڵ�����Χ�м�����ʧȥȫ���ᾧˮʱ��������Ϊm2g����x=_____________��