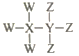题目内容
【题目】羟基自由基(·OH,电中性,O 为-1 价)是一种活性含氧微粒。常温下,利用·OH 处理含苯酚废水,可将其转化为无毒的氧化物。
(1)·OH 的电子式为________。
(2) pH=3 时 Fe2+催化 H2O2 的分解过程中产生·OH 中间体,催化循环反应如下。将方程式 ii 补充完整。
i.Fe2++ H2O2+H+ = Fe3++ H2O +·OH
ii.___ + ___= ___+ O2↑+2H+
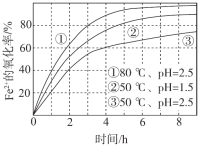
(3)已知:羟基自由基容易发生猝灭 2·OH = H2O2,从而活性降低.用 H2O2 分解产生的·OH 脱除苯酚,当其他条件不变时,不同温度下,苯酚的浓度随时间的变化如图 1 所示.0~20 min 时,温度从40℃上升到 50℃,反应速率基本不变的可能原因是________。
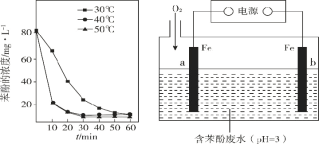
(4)利用电化学高级氧化技术可以在电解槽中持续产生·OH,使处理含苯酚废水更加高效,装置如图2所示。已知 a 极主要发生的反应是 O2 生成 H2O2,然后在电解液中产生·OH 并迅速与苯酚反应。
①b 极连接电源的________极(填“正”或“负”)。
②a 极的电极反应式为______。
③除电极反应外,电解液中主要发生的反应方程式有 ________ , _______。
【答案】![]() 2Fe3+ 2OH 2Fe2+ 温度从40℃上升到50℃,羟基自由基发生猝灭程度增大(或温度升高H2O2发生分解产生氧气),导致c(OH)下降,所以反应速率基本不变 正 O2+2e-+2H+=H2O2 Fe2++H2O2+H+=Fe3++H2O+OH或H2O2=2OH C6H6O+28OH=6CO2↑+17H2O
2Fe3+ 2OH 2Fe2+ 温度从40℃上升到50℃,羟基自由基发生猝灭程度增大(或温度升高H2O2发生分解产生氧气),导致c(OH)下降,所以反应速率基本不变 正 O2+2e-+2H+=H2O2 Fe2++H2O2+H+=Fe3++H2O+OH或H2O2=2OH C6H6O+28OH=6CO2↑+17H2O
【解析】
(1)羟基中O有1个单电子,O周围有7个电子,电子式为![]() ,故答案为
,故答案为![]() ;
;
(2)根据已知信息可知反应ii应该是Fe3+氧化OH生成Fe2+和O2,离子反应方程式为2Fe3++2OH=2Fe2++O2↑+2H+,故答案为:2Fe3+;2OH;2Fe2+;
(3)H2O2对热不稳定,温度升高,会导致H2O2发生分解,导致c(OH)下降,所以,温度从40℃上升到50℃,反应速率基本不变,故答案为:温度从40℃上升到50℃,羟基自由基发生猝灭程度增大(或温度升高H2O2发生分解产生氧气),导致c(OH)下降,所以反应速率基本不变;
(4)①a极主要发生的反应是O2生成H2O2,O元素化合价降低、得到电子、发生还原反应,则a电极为阴极、与电源负极相接,所以b电极为阳极、与电源正极相接,故答案为:正;
②a电极为阴极,O2得到电子生成H2O2,电解质溶液显酸性,电极反应式为O2+2e-+2H+=H2O2,故答案为:O2+2e-+2H+=H2O2;
③H2O2分解产生OH,方程式为H2O2=2OH,OH脱除苯酚成无毒的氧化物,该氧化物为CO2,反应的方程式为C6H6O+28OH=6CO2↑+17H2O,故答案为:H2O2=2OH,C6H6O+28OH=6CO2↑+17H2O。