��Ŀ����
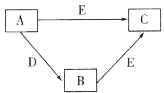
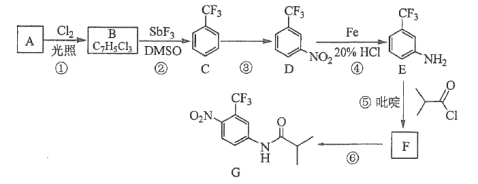
����Ŀ��������������(��)�γɵ�һ�������[Co(NH3)5NO2]Cl2���Ʊ��������£�
CoCl2��6H2O![]() [Co(NH3)5Cl]Cl2
[Co(NH3)5Cl]Cl2![]() [Co(NH3)5NO2]Cl2
[Co(NH3)5NO2]Cl2
(1)Co2+��̬��������Ų�ʽΪ___��
(2)�����[Co(NH3)5Cl]Cl2����Co3+�γ���λ����ԭ��Ϊ___(��Ԫ�ط���)��������[Co(NH3)5NO2]2+�������е�ԭ�ӵ��ӻ��������Ϊ___��
(3)NO![]() �Ŀռ乹��Ϊ___��������Ϊ�ȵ�����ķ���Ϊ___(д��ѧʽ)��
�Ŀռ乹��Ϊ___��������Ϊ�ȵ�����ķ���Ϊ___(д��ѧʽ)��
(4)H2O2��H2O��������������ܣ�����Ϊ���Ƕ��Ǽ��Է����⣬����Ϊ___��
(5)1mol[Co(NH3)5Cl]Cl2�к�����������ĿΪ___��
���𰸡�1s22s22p63s23p63d7��[Ar]3d7 N��Cl sp3��sp2 V�� SO2��O3 H2O2��H2O���Ӽ���γ���� 21NA
��������
(1)��̬Coԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d74s2��[Ar]3d74s2��ʧȥ������������ӱ�ΪCo2+��
(2)�����[Co(NH3)5Cl]Cl2��Co3+�ṩ�չ����NH3�ĵ�ԭ����Cl-�ṩ�µ��Ӷ��γ���λ������������[Co(NH3)5NO2]2+������ΪNH3��NO2-�����ݼ۵��ӻ������۷����ж�Nԭ�ӵ��ӻ����ͣ�
(3)����(2)�з����ж�NO2-�Ŀռ乹�ͣ��������ԭ�����ͼ۵���������ȵ�����Ϊ�ȵ����壻
(4)H2O2��H2O֮����γ������
(5)[Co(NH3)5Cl]Cl2��[Co(NH3)5Cl]2+��Cl-���ɣ�1mol[Co(NH3)5Cl]Cl2�к���1mol[Co(NH3)5Cl]2+��Co3+�γ�������λ����ÿ��NH3�к���3�����۵��������۵�������λ������������
(1)��̬Coԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d74s2��[Ar]3d74s2��ʧȥ�������ӱ�ΪCo2+�����̬Co2+��������Ų�ʽΪ1s22s22p63s23p63d7��[Ar]3d7��
(2)�����[Co(NH3)5Cl]Cl2��Co3+�ṩ�չ����NH3�ĵ�ԭ����Cl-�ṩ�µ��Ӷ��γ���λ��������Co3+�γ���λ����ԭ��ΪN��Cl��������[Co(NH3)5NO2]2+������ΪNH3��NO2-��NH3�еĵ�ԭ�ӳɼ�����Ϊ3���µ��Ӷ���Ϊ1���۲���Ӷ���Ϊ4���õ�ԭ�ӵ��ӻ��������Ϊsp3��NO2-�еĵ�ԭ�ӳɼ�����Ϊ2���µ��Ӷ���Ϊ1���۲���Ӷ���Ϊ3���õ�ԭ�ӵ��ӻ��������Ϊsp2��
(3)����(2)�з���NO2-�ĵ�ԭ�ӵ��ӻ��������Ϊsp2���ռ乹��ΪV�Σ�NO2-��3��ԭ�ӹ��ɣ��۲��������Ϊ18��������Ϊ�ȵ�����ķ���ΪSO2��O3��
(4)H2O2��H2O��������������ܣ�����Ϊ���Ƕ��Ǽ��Է����⣬����ΪH2O2��H2O���Ӽ���γ������
(5)1mol[Co(NH3)5Cl]Cl2�к���1mol[Co(NH3)5Cl]2+��Co3+�γ�������λ����ÿ��NH3�к���3�����۵��������۵�������λ����������������������ĿΪ(6+5��3)��1��NA=21NA��

 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�