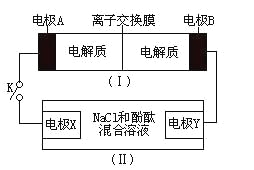
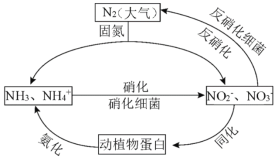
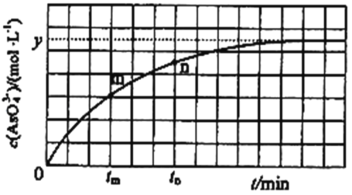
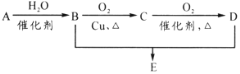
题目内容
【题目】根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
(1)氧化剂______,还原剂________
(2)氧化产物______,还原产物_______
(3)氧化剂与还原剂的物质的量之比:_________________________
(4)用单线桥的方法表示该反应的电子转移情况。________________________
(5)用双线桥的方法表示该反应的电子转移情况。_________________________
(6)当有8mol NH3参加反应时,转移的电子数目为__________
【答案】Cl2 NH3 N2 NH4Cl 3:2 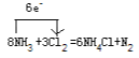
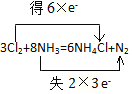 6mol
6mol
【解析】
该反应NH3中N元素化合价由-3价变为0价,化合价升高,所以氨气是还原剂,N2是氧化产物,氯气中氯元素化合价由0价变为-1价,化合价降低,所以Cl2是氧化剂,NH4Cl是还原产物。
(1)根据分析氧化剂为Cl2,还原剂为NH3;
(2)氧化产物为N2,还原产物为NH4Cl;
(3)氧化剂为Cl2,氨气作还原剂,但只有两个氮元素化合价升高,所以氧化剂和还原剂的物质的量之比为3:2;
(4) N元素化合价由-3价变为0价,化合价升高,每个氮原子失去3个电子,但只有两个氮原子化合价升高,即失去6个电子,氯元素化合价由0价变为-1价,化合价降低,得到电子,用单线桥表示为: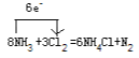 ;
;
(5) N元素化合价由-3价变为0价,化合价升高,每个氮原子失去3个电子,但只有两个氮原子化合价升高,氯元素化合价由0价变为-1价,化合价降低,得到电子,用双线桥表示为: ;
;
(6)当有8mol NH3参加反应时,化合价变化的NH3只有2mol,N元素化合价由-3价变为0价,所以转移的电子数目为6mol。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,回答下列问题:
主族周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)元素①的名称是______;元素②在周期表中所处位置________。
(2)元素②的简单氢化物的结构式为________;
(3)用电子式表示元素⑤与⑦的化合物的形成过程:__________________。
(4)表示④与⑨按原子个数比1:1形成的化合物的电子式:______,该化合物中含有的化学键的类型______。
(6)④、⑥、⑦、⑨四种元素形成的简单离子,离子半径由大到小的顺序是_____(请用离子符号表示)。