题目内容
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图装置。a和b不连接时,烧杯中发生反应的离子方程式为__________。
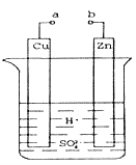
(2)a和b用导线连接,Cu极为原电池_____(填“正”或“负”)极,电极反应式是_______,发生_______(填“氧化”或“还原”)反应。
(3)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______。
(4)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因_____。
(5)如果把硫酸换成硫酸铜溶液,猜测____(填“锌极”或“铜极”)变粗,原因是____(用电极方程式表示)。
【答案】![]() 正
正 ![]() 还原 锌片不纯 没有自发的氧化还原反应,不能形成原电池 铜极
还原 锌片不纯 没有自发的氧化还原反应,不能形成原电池 铜极 ![]()
【解析】
⑴a和b不连接时,是锌和硫酸反应,锌不断溶解,产生气泡,其离子方程式是![]() ,故答案为:
,故答案为:![]() ;
;
⑵a和b用导线连接,Zn是活泼金属,作负极,发生氧化反应,Cu是较活泼金属,作正极,发生还原反应,电极反应式是![]() ,故答案为:正
,故答案为:正 ![]() 还原;
还原;
⑶正常情况下,原电池的负极上只发生氧化反应,故应该不会产生H2,但是观察到了气泡,只能是锌片上就形成了许多微小的原电池,即由于锌片不纯导致的,故答案为:锌片不纯;
⑷设计原电池的前提是必须有一个自发的放热的氧化还原反应,将锌片换成石墨,就不存在自发进行的氧化还原反应了,因此不能设计成原电池,故答案为:没有自发的氧化还原反应,不能形成原电池;
(5)如果把硫酸换成硫酸铜溶液,则负极是锌片,电极反应为:![]() ,铜电极为正极,电极反应为:
,铜电极为正极,电极反应为:![]() ,故铜极变粗,原因是
,故铜极变粗,原因是![]() ,故答案为:铜极
,故答案为:铜极 ![]() 。
。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,回答下列问题:
主族周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)元素①的名称是______;元素②在周期表中所处位置________。
(2)元素②的简单氢化物的结构式为________;
(3)用电子式表示元素⑤与⑦的化合物的形成过程:__________________。
(4)表示④与⑨按原子个数比1:1形成的化合物的电子式:______,该化合物中含有的化学键的类型______。
(6)④、⑥、⑦、⑨四种元素形成的简单离子,离子半径由大到小的顺序是_____(请用离子符号表示)。