题目内容
9.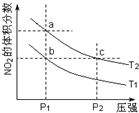 反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | a、c两点气体的颜色:a浅,c深 | |
| B. | a、c两点气体的平均相对分子质量:a>c | |
| C. | b、c两点的平衡常数:Kb=Kc | |
| D. | 状态a通过升高温度可变成状态b |
分析 2NO2(g)?N2O4(g)+57kJ,该反应为放热反应,若升高温度,化学平衡向着逆向移动,混合气体中NO2的体积分数增大;如果增大压强,化学平衡向着正向移动,混合气体中NO2的体积分数减小,然后结合图象来分析解答.
A、增大压强平衡向逆反应进行,向逆反应进行是减小由于压强增大导致浓度增大趋势,但到达平衡仍比原平衡浓度大;
B、增大压强,化学平衡逆向移动,c点时气体的物质的量小,混合气体的总质量不变;
C、化学平衡常数只与温度有关,温度不同,其平衡常数不同;
D、由状态a到状态b,压强不变,温度降低.
解答 解:A.由图象可知,a、c两点都在等温线上,c的压强大,与a相比c点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比a的浓度高,NO2为红棕色气体,则a、c两点气体的颜色:a浅、c深,故A正确;
B.由图象可知,a、c两点都在等温线上,c的压强大,增大压强,化学平衡逆向移动,c点时气体的物质的量小,混合气体的总质量不变,则平均相对分子质量大,即平均相对分子质量:a<c,故B错误;
C.化学平衡常数只与温度有关,温度不同,其平衡常数不同,升高温度,平衡向正反应方向移动,则二氧化氮的含量增大,所以温度T2>T1,温度越高,生成物的物质的量越大,所以其平衡常数越大,则b、c两点的平衡常数:b<c,故C错误;
D.升高温度,化学平衡向着逆向移动,NO2的体积分数减小,a点到b点二氧化氮体积分数减少,说明是降低了温度,所以不能用升高温度的方法实现由a点到b点的转变,故D错误;
故选A.
点评 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义,然后利用“定一议二”、“先拐先平”的方法进行解答即可,难度不大.

| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、Cl- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
| A. | 沸点:H2O>H2Se>H2S | B. | 酸性:H2SO4>H2CO3>HClO | ||
| C. | 硬度:I2>Br2>Cl2 | D. | 碱性:KOH>NaOH>Al(OH)3 |
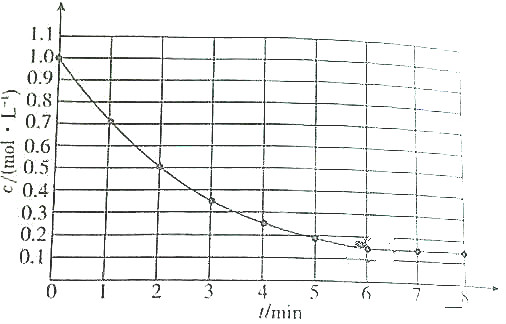
| A. | 第6min后,生成A的平均速率为0mol/(L•min) | |
| B. | A的平衡转化率为85% | |
| C. | 升高温度时,生成A的平均速率大于消耗A的平均速率 | |
| D. | 降低温度时,生成A的平均速率和消耗A的平均速率以不同倍数减少 |
| A. | 无色溶液中可能大量存在Al3+、NH4+、Na+、Cl?、S2?、AlO2- | |
| B. | c(H+):c(OH-)=1:1012的溶液中Mg2+、Cu2+、Fe2+、SO42-、Cl?、NO3-可以大量共存 | |
| C. | pH=8的溶液中可能大量存在Na+、K+、Ba2+、Cl-、HCO3-、NO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Al3+、Cl-、SO42-、NO3- |
| 选项 | 现象或事实 | 分析 |
| A | 发电厂将燃煤产生的废气通入高温下的石灰石 | 主要目的是生产CaSO4并得到副产品CO2 |
| B | ClO2代替Cl2对饮用水消毒 | ClO2消毒杀毒效率高,二次污染小 |
| C | 苏打、苛性钠可用于治疗胃酸过多 | 苏打、苛性钠都与胃酸反应 |
| D | 用环保绿色融雪除冰剂代替氯化钙、氯化钠融雪除冰 | 氯化钙、氯化钠会造成环境污染,但不会加速桥梁等设备腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
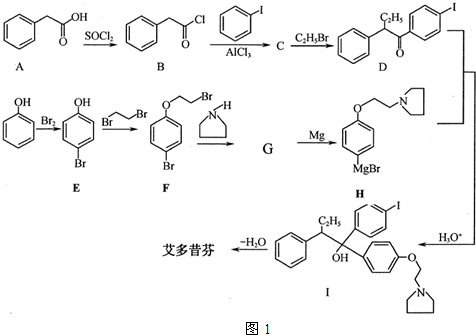
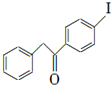 ; 艾多昔芬
; 艾多昔芬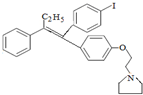 .
.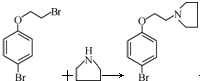 +HBr
+HBr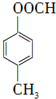 .
.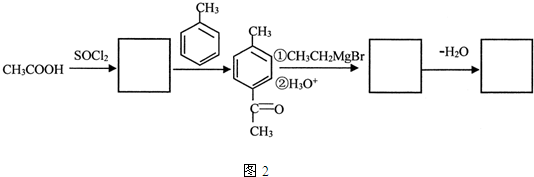
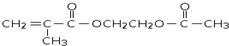 是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图: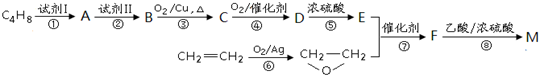
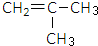 ,试剂II是NaOH水溶液.
,试剂II是NaOH水溶液.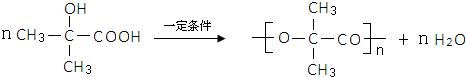 ;
;