题目内容
4.下列事实能用元素周期律解释的是( )| A. | 沸点:H2O>H2Se>H2S | B. | 酸性:H2SO4>H2CO3>HClO | ||
| C. | 硬度:I2>Br2>Cl2 | D. | 碱性:KOH>NaOH>Al(OH)3 |
分析 A、含氢键的物质沸点最高,氢化物的相对分子质量越大沸点越大;
B、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
C、物质的硬度主要是跟构成物质的原子排布有关系,跟元素种类以及元素周期律无关;
D、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答 解:A、含氢键的物质沸点最高,氢化物的相对分子质量越大沸点越大,则沸点为H2O>H2Se>H2S,故A错误;
B、非金属性:Cl>S>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性HClO4>H2SO4>H2CO3,HClO不是最高价含氧酸,不能利用此方法比较,故B错误;
C、物质的硬度主要是跟构成物质的原子排布有关系,跟元素种类以及元素周期律无关,故C错误;
D、金属性K>Na>Al,则最高价氧化物的水化物的碱性为:KOH>NaOH>Al(OH)3,故D正确,故选D.
点评 本题考查元素周期表与周期律的递变性,为高频考点,把握元素周期律、元素性质的比较等为解答的关键,学习中注重基础知识的积累,题目难度中等.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
14.X、Y、Z、W是短周期元素,原子序数依次递增,Y、Z、W原子的最外层电子数之和为14,X与Z位于同一主族,Y元素单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,下列说法正确的是( )
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | X、Z、W氧化物对应水化物酸性的强弱顺序为Z<X<W | |
| C. | 室温下,含Y元素的盐形成的水溶液其pH<7 | |
| D. | Z元素的单质和氧化物均既能与NaOH溶液反应也能与某种酸反应 |
15.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )


| A. | 分子中所有原子在同一平面上 | |
| B. | 分子中含有2种官能团 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出H+ |
12.磷酸分子间脱水会形成多种聚磷酸,它们的钠盐是广泛使用的食品添加剂.将48gNaOH与58.8g固态纯H3PO4在一定温度下加热,得到79.8g固体A和27g水,则A可能是( )
| A. | Na3PO4 | B. | Na4P2O7 | ||
| C. | Na4P2O7 和Na5P3O10 | D. | Na3PO4、Na4P2O7和Na5P3O10 |
9.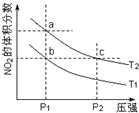 反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
 反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | a、c两点气体的颜色:a浅,c深 | |
| B. | a、c两点气体的平均相对分子质量:a>c | |
| C. | b、c两点的平衡常数:Kb=Kc | |
| D. | 状态a通过升高温度可变成状态b |
10.如图为周期表的一部分,所有元素都是主族元素,不正确的是( )
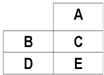

| A. | E的核电荷数大于B | |
| B. | A、C若为非金属,则对应氢化物的稳定性:A>C | |
| C. | B、D若为金属,其最高价氧化物对应水化物碱性:D>B | |
| D. | A一定是非金属元素 |