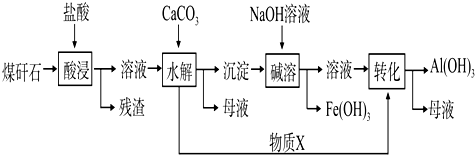
题目内容
15.化学与生产、生活关系密切,下列现象或事实及其分析都正确的是( )| 选项 | 现象或事实 | 分析 |
| A | 发电厂将燃煤产生的废气通入高温下的石灰石 | 主要目的是生产CaSO4并得到副产品CO2 |
| B | ClO2代替Cl2对饮用水消毒 | ClO2消毒杀毒效率高,二次污染小 |
| C | 苏打、苛性钠可用于治疗胃酸过多 | 苏打、苛性钠都与胃酸反应 |
| D | 用环保绿色融雪除冰剂代替氯化钙、氯化钠融雪除冰 | 氯化钙、氯化钠会造成环境污染,但不会加速桥梁等设备腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、主要目的是减少二氧化硫的排放;
B、相同物质的量的ClO2转移电子数Cl2的2倍,其消毒能力比为2:1;
C、苏打、苛性钠的碱性强,具有强腐蚀性;
D、氯化钙、氯化钠是电解质与桥梁的钢铁构成原电池.
解答 解:A、2CaCO3+O2+2SO2═2CaSO4+CO2,主要目的是减少二氧化硫的排放,而不是生产CaSO4,故A错误;
B、而相同物质的量的ClO2和Cl2,其消毒能力比为2:1,而不再产生二次污染,故B正确;
C、苏打、苛性钠的碱性强,具有强腐蚀性,不适宜冶胃酸,故C错误;
D、氯化钙、氯化钠是电解质与桥梁的钢铁构成原电池,加快化学反应的速率,所以加速桥梁等设备腐蚀,故D错误;
故选B.
点评 本题考查发电厂二氧化硫气体的处理、自来水的消毒、治疗胃酸过多和电化学,综合性强,但比较容易.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
9.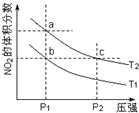 反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
 反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)+57kJ,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | a、c两点气体的颜色:a浅,c深 | |
| B. | a、c两点气体的平均相对分子质量:a>c | |
| C. | b、c两点的平衡常数:Kb=Kc | |
| D. | 状态a通过升高温度可变成状态b |
10.如图为周期表的一部分,所有元素都是主族元素,不正确的是( )
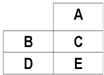

| A. | E的核电荷数大于B | |
| B. | A、C若为非金属,则对应氢化物的稳定性:A>C | |
| C. | B、D若为金属,其最高价氧化物对应水化物碱性:D>B | |
| D. | A一定是非金属元素 |
20.下列叙述不正确的是( )
| A. | 同周期元素的原子半径以ⅦA族的为最小 | |
| B. | 在周期表中零族元素的单质全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子 | |
| D. | 所有主族元素的原子形成单原子离子时的最高正价数都和它的族数相等 |
7.自来水厂生产自来水的工艺流程示意图如图所示

“加氯”是指加入含有氯元素的物质,该物质可以是( )

“加氯”是指加入含有氯元素的物质,该物质可以是( )
| A. | 氯气 | B. | ClO2 | C. | NaCl | D. | NaClO3 |
5.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA |