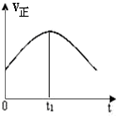
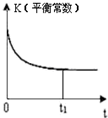
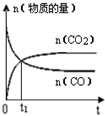
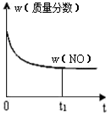
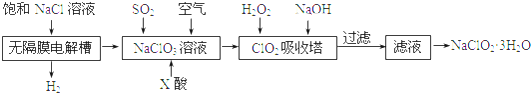
题目内容
6. 实验室中只有0.1000mol•L-1的酸性KMnO4溶液,甲同学用下图所示操作配制100mL0.0010mol•L-1的KMnO4溶液,指出其中的两处错误称取酸性高锰酸钾选用碱式滴定管、在容量瓶稀释浓溶液.
实验室中只有0.1000mol•L-1的酸性KMnO4溶液,甲同学用下图所示操作配制100mL0.0010mol•L-1的KMnO4溶液,指出其中的两处错误称取酸性高锰酸钾选用碱式滴定管、在容量瓶稀释浓溶液.
分析 高锰酸钾具有强的氧化性,结合酸式滴定管、碱式滴定管的构造特点及使用注意事项、容量瓶的使用注意事项解答.
解答 解:高锰酸钾具有强的氧化性,能够使橡胶老化,所以应选择酸式滴定管量取;
容量瓶为精密仪器,不能用来稀释浓溶液;
故答案为:称取酸性高锰酸钾选用碱式滴定管;在容量瓶中稀释浓溶液.
点评 本题考查了仪器的使用,熟悉滴定管、容量瓶的构造及使用注意事项是解题关键,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
16.下列有关各实验的叙述中正确的是( )
| A. | 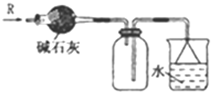 可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 可用于SO2气体的干燥,收集并吸收多余SO2气体,防止SO2逸出污染空气并防止倒吸 | |
| B. | 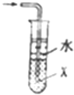 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| C. |  进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集 进行H2,NH3,CO2,Cl,HCl,NO2等气体收集,但不能用于NO气体收集 | |
| D. | 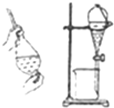 利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 利用氯仿(CHCl3)密度大于乙醇,进行氯仿与乙醇混合物的分离 |
14.下列离子方程式书写正确的是( )
| A. | 用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
1.Cl2是一种重要的化工原料.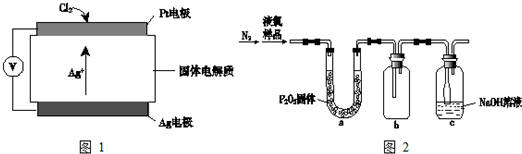
(1)电解饱和NaCl溶液获得Cl2的化学方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+OH-
(2)为便于储存,要将氯气液化[Cl2(g)?Cl2(l)],应采取的措施是加压或降温(写出一条即可).
(3)液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O═SO42-+3H++2Cl-
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③氯气含量检测仪工作原理示意图如图1:Cl2在Pt电极放电的电极反应式是2Ag++Cl2+2e-=2AgCl↓
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图2所示:(已知:P2O5+3H2O═2H3PO4;Cl2与P2O5不反应.)
用离子方程式说明c装置的作用Cl2+2OH-═Cl-+ClO-+H2O.

(1)电解饱和NaCl溶液获得Cl2的化学方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+OH-
(2)为便于储存,要将氯气液化[Cl2(g)?Cl2(l)],应采取的措施是加压或降温(写出一条即可).
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③氯气含量检测仪工作原理示意图如图1:Cl2在Pt电极放电的电极反应式是2Ag++Cl2+2e-=2AgCl↓
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图2所示:(已知:P2O5+3H2O═2H3PO4;Cl2与P2O5不反应.)
用离子方程式说明c装置的作用Cl2+2OH-═Cl-+ClO-+H2O.
2.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| B. | 将1mol氯气通入足量水中发生反应转移电子数为 NA | |
| C. | 585 g氯化钠晶体中约含有6.02×1022个氯化钠分子 | |
| D. | 常温下,200 ml、0.5 mol•L-1的Na2CO3溶液中阴离子数目等于0.1 NA |