题目内容
13.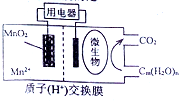 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )| A. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm(H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g. |
分析 分子组成为Cm(H2O)n的物质不一定为糖类,如甲醛、乳酸、乙酸乙酯等物质,形成原电池时,微生物所在电极区发生氧化反应,Cm(H2O)n被氧化生成水和二氧化碳,MnO2被还原生成Mn2+,为原电池的正极,放电时,阳离子向正极移动,阴离子向负极移动,以此解答.
解答 解:A.分子组成为Cm(H2O)n的物质不一定为糖类,如甲醛、乳酸、乙酸乙酯等物质,故A错误;
B.MnO2被还原生成Mn2+,为原电池的正极,电极方程式为MnO2+4H++2e-═Mn2++2H2O,故B正确;
C.原电池工作时,阳离子向正极移动,阴离子向负极移动,故C错误;
D.若Cm(H2O)n是葡萄糖,C元素化合价可认定为0价,当电路中转移了6NA电子时,反应的葡萄糖的物质的量为0.25mol,质量是0.25mol×180g/mol=45g,故D错误.
故选B.
点评 本题考查新型电池,为高频考点,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
1.Cl2是一种重要的化工原料.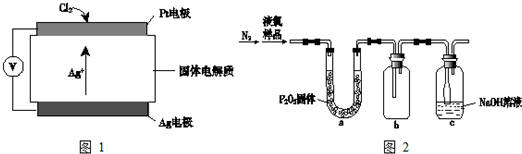
(1)电解饱和NaCl溶液获得Cl2的化学方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+OH-
(2)为便于储存,要将氯气液化[Cl2(g)?Cl2(l)],应采取的措施是加压或降温(写出一条即可).
(3)液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O═SO42-+3H++2Cl-
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③氯气含量检测仪工作原理示意图如图1:Cl2在Pt电极放电的电极反应式是2Ag++Cl2+2e-=2AgCl↓
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图2所示:(已知:P2O5+3H2O═2H3PO4;Cl2与P2O5不反应.)
用离子方程式说明c装置的作用Cl2+2OH-═Cl-+ClO-+H2O.

(1)电解饱和NaCl溶液获得Cl2的化学方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+OH-
(2)为便于储存,要将氯气液化[Cl2(g)?Cl2(l)],应采取的措施是加压或降温(写出一条即可).
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③氯气含量检测仪工作原理示意图如图1:Cl2在Pt电极放电的电极反应式是2Ag++Cl2+2e-=2AgCl↓
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图2所示:(已知:P2O5+3H2O═2H3PO4;Cl2与P2O5不反应.)
用离子方程式说明c装置的作用Cl2+2OH-═Cl-+ClO-+H2O.
18.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16下列关于不溶物之间转化说法错误的是( )
| A. | AgI比AgCl更难溶于水,所以AgCl易转化为AgI | |
| B. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| C. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| D. | AgCl不溶于水,不能转化为AgI |
2.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| B. | 将1mol氯气通入足量水中发生反应转移电子数为 NA | |
| C. | 585 g氯化钠晶体中约含有6.02×1022个氯化钠分子 | |
| D. | 常温下,200 ml、0.5 mol•L-1的Na2CO3溶液中阴离子数目等于0.1 NA |




 化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底.回答下列问题: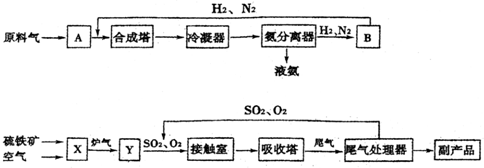
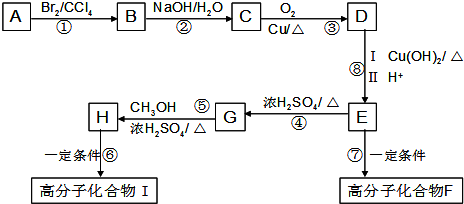
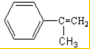 (2)E中的官能团名称是羟基、羧基
(2)E中的官能团名称是羟基、羧基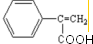 (4)反应②、④的反应类型分别是取代反应、消去反应
(4)反应②、④的反应类型分别是取代反应、消去反应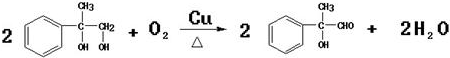 ;反应⑦n
;反应⑦n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$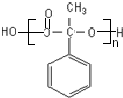 +(n-1)H2O;
+(n-1)H2O;