题目内容
9.下表为元素周期表的一部分,用元素符号或化学式回答下列问题.| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为Cl->K+>Ca2+>Na+>Mg2+>Al3+
(4)元素⑦的氢化物的化学式为H2O;该氢化物和元素②单质反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)①⑨形成的化合物灼烧时火焰焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为Cl2+2NaBr=2NaCl+Br2 .
(6)①、⑤和⑧最高价氧化物对应水化物间相互反应的离子方程式Al(OH)3+3H+═Al3++2H2O、Al(OH)3+OH-═AlO2-+2H2O、H++OH-=H2O.
(7)③的单质在⑥⑦形成化合物中燃烧的化学方程式为CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为橙红色;⑦⑧⑨形成氢化物的稳定性由强到弱顺序为H2O>HCl>HBr.
分析 由元素在周期表中的位置,可知①是Na,②是K,③是Mg,④是Ca,⑤是Al,⑥是C,⑦是O,⑧是Cl,⑨是Br,⑩是Ar.
(1)稀有气体化学性质最不活泼;同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)元素⑦的氢化物为水,钾与水反应生成KOH与氢气;
(5)①⑨形成的化合物为NaBr,含有Na元素,焰色反应为黄色,NaBr与氯气反应生成NaCl与溴单质;
(6)①、⑤和⑧最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4;
(7)Mg在二氧化碳中燃烧生成MgO与碳;溴的四氯化碳溶液为橙红色;元素非金属性越强,其氢化物越稳定.
解答 解:由元素在周期表中的位置,可知①是Na,②是K,③是Mg,④是Ca,⑤是Al,⑥是C,⑦是O,⑧是Cl,⑨是Br,⑩是Ar.
(1)稀有气体Ar化学性质最不活泼;同周期自左而右原子半径减小、同主族自上而下原子半径增大,故K原子半径最大,
故答案为:Ar;K;
(2)金属性K>Na>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,故KOH的碱性最强,
故答案为:KOH;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Cl->K+>Ca2+>Na+>Mg2+>Al3+,
故答案为:Cl->K+>Ca2+>Na+>Mg2+>Al3+;
(4)元素⑦的氢化物为H2O,钾与水反应生成KOH与氢气,反应方程式为:2K+2H2O=2KOH+H2↑,
故答案为:H2O;2K+2H2O=2KOH+H2↑;
(5)①⑨形成的化合物为NaBr,含有Na元素,灼烧时火焰焰色为黄色,NaBr与氯气反应生成NaCl与溴单质,反应方程式为:Cl2+2NaBr=2NaCl+Br2 ,
故答案为:黄色;Cl2+2NaBr=2NaCl+Br2 ;
(6)①、⑤和⑧最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4,相互反应离子方程式为:Al(OH)3+3H+═Al3++2H2O、Al(OH)3+OH-═AlO2-+2H2O、H++OH-=H2O,
故答案为:Al(OH)3+3H+═Al3++2H2O、Al(OH)3+OH-═AlO2-+2H2O、H++OH-=H2O;
(7)⑥⑦形成化合物为二氧化碳,Mg在二氧化碳中燃烧生成MgO与碳,反应方程式为:CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;⑥⑧形成化合物为四氯化碳,溴溶于四氯化碳溶液后溶液呈橙红色;非金属性O>Cl>Br,元素非金属性越强,其氢化物越稳定,故氢化物稳定性:H2O>HCl>HBr,
故答案为:CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;橙红色;H2O>HCl>HBr.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,注意对元素周期律的理解掌握,有利于基础知识的巩固.

| A. | r(S2-)>r(O2-)>r(F-) | B. | r(Al)>r(Mg)>r(Na) | C. | r(Na+)>r(O2-)>r(F-) | D. | r(Na)>r(Na+)>r(Cl-) |
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ | |
| C. | 反应达平衡时,若升高温度,则硅的产量会提高 | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入200mL 1mol•L-1的NaOH恰好反应 |
| A. | 各物质的浓度之比为1:3:3 | |
| B. | 混合物各物质的浓度相等 | |
| C. | ν(A)、ν(B)、ν(C) 之比为1:3:3 | |
| D. | A、B、C三种物质的浓度不随时间变化而变化 |
| A. | 每一个水分子内含有两个氢键 | |
| B. | 冰、水和水蒸气中都存在氢键 | |
| C. | 分子间形成的氢键使物质的熔点和沸点升高 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
| A. | 在托盘天平上放两片大小相同的纸,然后将氢氧化钠放在纸上称取 | |
| B. | 把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,把溶液转入容量瓶 | |
| C. | 用蒸馏水洗涤烧杯、玻棒2~3次,洗涤液也移入容量瓶 | |
| D. | 沿着玻棒往容量瓶中加蒸馏水,接近刻度时,改用胶头滴管滴加直至溶液凹液面的最低点与刻线相切 |
 按如图装置进行如下实验,请用你所学知识完成下题:
按如图装置进行如下实验,请用你所学知识完成下题: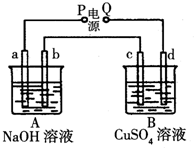 按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.
按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极. ;
;