题目内容
1.在一定条件下,一定量的A和B气体发生如下可逆反应:A(g)+3B(g)?3C(g),说明反应已到达平衡的是( )| A. | 各物质的浓度之比为1:3:3 | |
| B. | 混合物各物质的浓度相等 | |
| C. | ν(A)、ν(B)、ν(C) 之比为1:3:3 | |
| D. | A、B、C三种物质的浓度不随时间变化而变化 |
分析 根据平衡状态的特征判断:(1)v(正)=v(逆),(2)混合物中各组成成分的浓度、百分含量不变分析.
解答 解:A、反应达到平衡时的浓度与反应的初始物质的量以及反应的转化程度有关,所以不能作为判断依据,故A错误;
B、平衡状态时各组分浓度大小决定于开始加入的多少,与平衡状态无关,故B错误;
C、无论反应是否平衡,各物质的反应速率之比等于计量数之比,故C错误;
D、反应达到平衡时,混合物中各组成成分的浓度不变,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,紧扣化学平衡状态的特征判断即可.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
9.下表为元素周期表的一部分,用元素符号或化学式回答下列问题.
(1)10种元素中,化学性质最不活泼的是Ar,除⑩外原子半径最大的是K.
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为Cl->K+>Ca2+>Na+>Mg2+>Al3+
(4)元素⑦的氢化物的化学式为H2O;该氢化物和元素②单质反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)①⑨形成的化合物灼烧时火焰焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为Cl2+2NaBr=2NaCl+Br2 .
(6)①、⑤和⑧最高价氧化物对应水化物间相互反应的离子方程式Al(OH)3+3H+═Al3++2H2O、Al(OH)3+OH-═AlO2-+2H2O、H++OH-=H2O.
(7)③的单质在⑥⑦形成化合物中燃烧的化学方程式为CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为橙红色;⑦⑧⑨形成氢化物的稳定性由强到弱顺序为H2O>HCl>HBr.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为Cl->K+>Ca2+>Na+>Mg2+>Al3+
(4)元素⑦的氢化物的化学式为H2O;该氢化物和元素②单质反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)①⑨形成的化合物灼烧时火焰焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为Cl2+2NaBr=2NaCl+Br2 .
(6)①、⑤和⑧最高价氧化物对应水化物间相互反应的离子方程式Al(OH)3+3H+═Al3++2H2O、Al(OH)3+OH-═AlO2-+2H2O、H++OH-=H2O.
(7)③的单质在⑥⑦形成化合物中燃烧的化学方程式为CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为橙红色;⑦⑧⑨形成氢化物的稳定性由强到弱顺序为H2O>HCl>HBr.
16.下列实验能成功的是( )
| A. | 用3体积的乙醇与l体积的浓H2SO4混合加热到170℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)在启普发生器中制乙炔 | |
| D. | 以硫酸、碳酸钠、苯酚钠溶液为试剂,验证酸性强弱关系:硫酸>碳酸>石炭酸 |
6.将如图所示实验装置的K闭合,下列判断正确的是( )
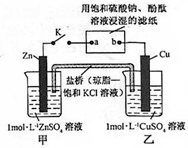

| A. | 片刻后甲池中c(SO42-)增大 | B. | 电子沿 Zn→a→b→Cu 路径流动 | ||
| C. | Cu 电极上发生还原反应 | D. | 片刻后可观察到滤纸b点变红色 |
10.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 甲醛是一种有刺激性气味的气体 | |
| B. | 石油通过裂解可以得到更多的汽油,可以满足工业需求 | |
| C. | 乙醇易溶于水是因为含有羟基 | |
| D. | 氟氯代烷产生的自由基可以作为催化剂使O3转化为O2,从而破坏臭氧层 |
11.胶体与溶液的本质区别是( )
| A. | 丁达尔效应 | B. | 是否能通过半透膜 | ||
| C. | 分散剂粒子的大小 | D. | 分散质粒子的大小 |

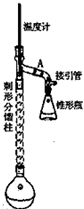 乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
 ”表示)位于该正方体的顶点或面心;阴离子(用“
”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)位于小正方体的中心.根据以上信息,回答下列问题:A至E的元素名称:
”表示)位于小正方体的中心.根据以上信息,回答下列问题:A至E的元素名称: