题目内容
20.下列粒子半径大小的比较中正确的是( )| A. | r(S2-)>r(O2-)>r(F-) | B. | r(Al)>r(Mg)>r(Na) | C. | r(Na+)>r(O2-)>r(F-) | D. | r(Na)>r(Na+)>r(Cl-) |
分析 A.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;
B.同周期自左而右原子半径减小;
C.电子层结构相同的离子,核电荷数越大离子半径越小;
D.电子层越多离子半径越大.
解答 解:A.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(S2-)>r(O2-)>r(F-),故A正确;
B.同周期自左而右原子半径减小,故原子半径:r(Al)<r(Mg)<r(Na),故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(F-)>r(Na+),故C错误;
D.电子层越多离子半径越大,故离子半径:r(Na+)<r(Cl-),故D错误,
故选A.
点评 本题考查微粒半径比较,比较基础,明确半径比较规律即可解答,注意对元素周期律的理解.

练习册系列答案
相关题目
8.分析下列材料,选择将乙二醇和丙三醇的混合物分离的适宜方法是
( )
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3. | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 与水和酒精等混溶 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 与水和酒精等混溶 |
| A. | 蒸馏法 | B. | 萃取法 | ||
| C. | “溶解、结晶、过滤”的方法 | D. | 分液法 |
15.下列物质性质的递变关系正确的是( )
| A. | 酸性强弱:HClO3>H2SO3>H3PO4 | B. | 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性HCl>H2S>PH3 | D. | 氧化性Na+>Mg2+>Al3+ |
9.下表为元素周期表的一部分,用元素符号或化学式回答下列问题.
(1)10种元素中,化学性质最不活泼的是Ar,除⑩外原子半径最大的是K.
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为Cl->K+>Ca2+>Na+>Mg2+>Al3+
(4)元素⑦的氢化物的化学式为H2O;该氢化物和元素②单质反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)①⑨形成的化合物灼烧时火焰焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为Cl2+2NaBr=2NaCl+Br2 .
(6)①、⑤和⑧最高价氧化物对应水化物间相互反应的离子方程式Al(OH)3+3H+═Al3++2H2O、Al(OH)3+OH-═AlO2-+2H2O、H++OH-=H2O.
(7)③的单质在⑥⑦形成化合物中燃烧的化学方程式为CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为橙红色;⑦⑧⑨形成氢化物的稳定性由强到弱顺序为H2O>HCl>HBr.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为Cl->K+>Ca2+>Na+>Mg2+>Al3+
(4)元素⑦的氢化物的化学式为H2O;该氢化物和元素②单质反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)①⑨形成的化合物灼烧时火焰焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为Cl2+2NaBr=2NaCl+Br2 .
(6)①、⑤和⑧最高价氧化物对应水化物间相互反应的离子方程式Al(OH)3+3H+═Al3++2H2O、Al(OH)3+OH-═AlO2-+2H2O、H++OH-=H2O.
(7)③的单质在⑥⑦形成化合物中燃烧的化学方程式为CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为橙红色;⑦⑧⑨形成氢化物的稳定性由强到弱顺序为H2O>HCl>HBr.
10.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 甲醛是一种有刺激性气味的气体 | |
| B. | 石油通过裂解可以得到更多的汽油,可以满足工业需求 | |
| C. | 乙醇易溶于水是因为含有羟基 | |
| D. | 氟氯代烷产生的自由基可以作为催化剂使O3转化为O2,从而破坏臭氧层 |

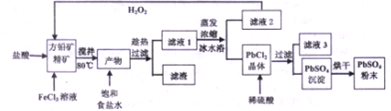
 乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下: