题目内容
4.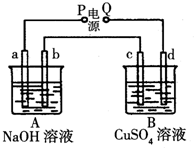 按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.
按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.(1)标准状况下,b极产生气体的体积为2.8L.
(2)c极上析出固体的质量为16g.
分析 c极上有Cu析出,说明c为电解池的阴极,d为阳极,则P为负极,Q为正极,A为电解NaOH溶液,实质上为电极水,B为电解硫酸铜溶液,在阴极析出铜,电极反应:Cu2++2e-=Cu,阳极生成氧气,发生4OH--4e-=2H2O+O2↑,结合电极方程式计算.
解答 解:(1)被电解的水的质量为4.5g,n(H2O)=$\frac{4.5g}{18g/mol}$=0.25mol,A总反应式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,由此可知b电极生成氧气0.125mol,标准状况下体积=0.125mol×22.4L/mol=2.8L,故答案为:2.8;
(2)b电极为阳极,溶液中氢氧根离子失电子生成氧气,电极反应为4OH--4e-═2H2O+O2↑,得到氧气0.125mol,电子转移为0.125mol×4=0.5mol;C电极析出的是铜,由电极反应Cu2++2e-═Cu,计算得到生成铜物质的量为0.25mol,质量=0.25mol×64g/mol=16g,故答案为:16.
点评 本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意电解池为串联电路,各电极上得失电子的数目相等.做题时要正确写出电极方程式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.用下列物质或方法处理蛋白质溶液,蛋白质没有发生变性的是( )
| A. | 加入食盐水 | B. | 加入硫酸铜溶液 | C. | 煮沸 | D. | 加入浓硝酸 |
15.下列物质性质的递变关系正确的是( )
| A. | 酸性强弱:HClO3>H2SO3>H3PO4 | B. | 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性HCl>H2S>PH3 | D. | 氧化性Na+>Mg2+>Al3+ |
19.已知2NO2 (棕红色)═N2O4(无色).在某支针简中抽入10mlNO2气体并封闭尖端,快速将活塞推至5ml处,其颜色变化是( )
| A. | 变深 | B. | 变浅 | C. | 先变深后变浅 | D. | 先变浅后变深 |
9.下表为元素周期表的一部分,用元素符号或化学式回答下列问题.
(1)10种元素中,化学性质最不活泼的是Ar,除⑩外原子半径最大的是K.
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为Cl->K+>Ca2+>Na+>Mg2+>Al3+
(4)元素⑦的氢化物的化学式为H2O;该氢化物和元素②单质反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)①⑨形成的化合物灼烧时火焰焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为Cl2+2NaBr=2NaCl+Br2 .
(6)①、⑤和⑧最高价氧化物对应水化物间相互反应的离子方程式Al(OH)3+3H+═Al3++2H2O、Al(OH)3+OH-═AlO2-+2H2O、H++OH-=H2O.
(7)③的单质在⑥⑦形成化合物中燃烧的化学方程式为CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为橙红色;⑦⑧⑨形成氢化物的稳定性由强到弱顺序为H2O>HCl>HBr.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为Cl->K+>Ca2+>Na+>Mg2+>Al3+
(4)元素⑦的氢化物的化学式为H2O;该氢化物和元素②单质反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)①⑨形成的化合物灼烧时火焰焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为Cl2+2NaBr=2NaCl+Br2 .
(6)①、⑤和⑧最高价氧化物对应水化物间相互反应的离子方程式Al(OH)3+3H+═Al3++2H2O、Al(OH)3+OH-═AlO2-+2H2O、H++OH-=H2O.
(7)③的单质在⑥⑦形成化合物中燃烧的化学方程式为CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为橙红色;⑦⑧⑨形成氢化物的稳定性由强到弱顺序为H2O>HCl>HBr.
16.下列实验能成功的是( )
| A. | 用3体积的乙醇与l体积的浓H2SO4混合加热到170℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)在启普发生器中制乙炔 | |
| D. | 以硫酸、碳酸钠、苯酚钠溶液为试剂,验证酸性强弱关系:硫酸>碳酸>石炭酸 |
14.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | AgCl沉淀易转化成AgI沉淀且Ksp(AgX)═c(Ag+)•c(X-),故Ksp(AgI)>K(AgCl) | |
| C. | 在Na2S稀溶液中,c(Na+)═2c(S2-)+2c(H2S)+2c(HS-) | |
| D. | 将pH=10的氨水稀释后,溶液中所有离子的浓度均降低 |
 乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
 ”表示)位于该正方体的顶点或面心;阴离子(用“
”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)位于小正方体的中心.根据以上信息,回答下列问题:A至E的元素名称:
”表示)位于小正方体的中心.根据以上信息,回答下列问题:A至E的元素名称: