题目内容
5.对于实验Ⅰ~Ⅳ的实验现象预测正确的是(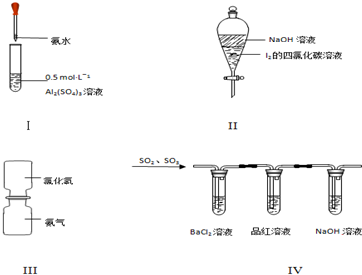
| A. | 实验Ⅰ:试管中先出现白色胶状物质,后溶解 | |
| B. | 实验Ⅱ:振荡后静置,下层溶液颜色保持不变 | |
| C. | 实验Ⅲ:抽去中间玻璃片,瓶内没有任何现象 | |
| D. | 实验Ⅳ:BaCl2溶液变浑浊,品红溶液褪色 |
分析 A.氢氧化铝只溶于强碱;
B.碘和氢氧化钠溶液反应;
C.氨气和氯化氢气体反应生成白烟;
D.三氧化硫和水反应生成硫酸,硫酸和钡离子反应生成硫酸钡沉淀,二氧化硫和品红溶液反应生成无色物质.
解答 解:A.氢氧化铝只溶于强碱,氨水为弱碱,不能与氢氧化铝反应,故A错误;
B.碘和氢氧化钠溶液反应,四氯化碳层无色,故B错误;
C.氨气和氯化氢气体相遇立即反应生成白烟氯化铵,所以实验III:抽去中间玻璃片,瓶内产生白烟,故C错误;
D.三氧化硫和水反应生成硫酸,硫酸和氯化钡反应生成硫酸钡白色沉淀,二氧化硫和氯化钡不反应,二氧化硫和品红溶液反应生成无色物质,所以品红溶液褪色,故D正确;
故选:D.
点评 本题考查较为综合,涉及气体的制备、物质的分离以及萃取等,注意氢氧化铝不溶于弱碱但能溶于强碱,明确“烟”和“雾”的区别.

练习册系列答案
相关题目
15.下列有关化学实验的叙述正确的是( )
| A. | 将CH3CH2Br与NaOH溶液共热,冷却,取上层溶液加AgNO3溶液,观察是否产生淡黄色沉淀,检验CH3CH2Br与NaOH溶液是否发生反应 | |
| B. | 在实验室,将乙醇和浓硫酸的混合物共热发生反应,生成能使酸性KMnO4溶液褪色的气体,此气体一定是乙烯 | |
| C. | 室温下向苯和少量苯酚的混合液中加入适量烧碱溶液,振荡、静置后分液,可除去其中的苯酚 | |
| D. | 将硝酸银溶液和少量乙醛于试管中充分混合后,把试管放在热水浴中加热,在试管内壁上有光亮的银镜出现 |
16. 据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )
据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )
 据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )
据媒体报道,一些非法油厂用大豆油、棕榈油、粗制棉油等添加香精勾兑成花生油.如图就是一种香精的结构,下列对该香精的叙述不正确的是( )| A. | 该香精能够水解,其水解产物中有醇 | |
| B. | 该香精能够使酸性KMnO4溶液褪色 | |
| C. | 该香精能够与溴水发生加成反应 | |
| D. | 1 mol该香精中含有1 mol碳氧双键和4 mol碳碳双键 |
13.对于10mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是( )
①升高温度; ②改用10mL 3mol/L盐酸; ③改用30mL 1mol/L醋酸;
④用等量锌粉代替锌粒; ⑤改用10mL 3mol/L硝酸.
①升高温度; ②改用10mL 3mol/L盐酸; ③改用30mL 1mol/L醋酸;
④用等量锌粉代替锌粒; ⑤改用10mL 3mol/L硝酸.
| A. | ①②④ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
20.下列反应的离子方程式正确( )
| A. | 铜与稀硝酸反应 Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O | |
| B. | 稀碳酸钠溶液中通入二氧化碳 CO32-+CO2+H2O=2HCO3- | |
| C. | 在氯化铝溶液中滴入氨水 Al3++4NH3•H2O=AlO2-+4NH4+ | |
| D. | 向次氯酸钙溶液中通入SO2 Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
10.在${\;}_{m}^{n}$X${\;}_{q}^{p}$ 中,m、n、p、q表示某种元素X的四个角码,若X1与X2的q均为1,m、p的值相等,而n值不相等,则X1和X2表示的可能是( )
| A. | 不同的原子 | B. | 同一元素的不同原子或离子 | ||
| C. | 不同元素的离子 | D. | 不同的元素 |
17.在密闭容器中进行反应2SO2+O2?2SO3,SO2、O2、SO3的起始浓度分别为0.2mol•L-1,0.1mol•L-1,0,2mol•L-1,当平衡时,下列数据正确的是( )
| A. | SO2的浓度为0.25 mol•L-1,SO3的浓度为0.25mol•L-1 | |
| B. | SO3的浓度为0.3mol•L-1 | |
| C. | SO2的浓度为0.4 mol•L-1,O2的浓度为0.2 mol•L-1 | |
| D. | SO3的浓度为0.4 mol•L-1 |
14.科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )


| A. | a为正极,b为负极 | |
| B. | 生产过程中a电极质量减轻 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
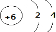 E的电子式为
E的电子式为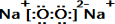 ;
;