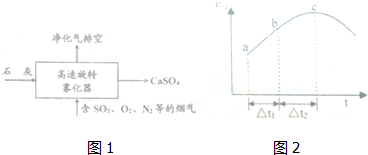
题目内容
15.短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和.(1)A的原子结构示意图是
 E的电子式为
E的电子式为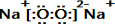 ;
;(2)D在周期表中的位置是第三周期第VIA族.它的下一周期同族元素最高价氧化物对应的水化物的分子式为H2SeO4;
(3)C与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑,写出所得溶液中含有10个电子的微粒符号Na+、OH-、H2O.
分析 A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,据此解答.
解答 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素、C为Na元素;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,核外各层电子分别为2、8、6,则D为S元素,
(1)6号碳原子的结构示意图是: E是过氧化钠,其电子式为:
E是过氧化钠,其电子式为: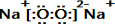 ,故答案为:
,故答案为: ;
;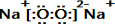 ;
;
(2)16号硫在周期表中的位置是第三周期第VIA族,它的下一周期是Se,最高价氧化物对应水化物的分子式为:H2SeO4,故答案为:第三周期第VIA族;H2SeO4;(3)钠与水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,氢氧化钠溶液中含有10个电子的微粒有:Na+、OH-、H2O,故答案为:2Na+2H2O=2NaOH+H2↑;Na+、OH-、H2O.
点评 本题考查结构性质位置关系应用,侧重对化学用语的考查,比较基础,注意对基础知识的积累掌握.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
5.对于实验Ⅰ~Ⅳ的实验现象预测正确的是(


| A. | 实验Ⅰ:试管中先出现白色胶状物质,后溶解 | |
| B. | 实验Ⅱ:振荡后静置,下层溶液颜色保持不变 | |
| C. | 实验Ⅲ:抽去中间玻璃片,瓶内没有任何现象 | |
| D. | 实验Ⅳ:BaCl2溶液变浑浊,品红溶液褪色 |
6.下列关于化学反应限度的说法中不正确的是( )
| A. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 | |
| B. | 当一个可逆反应进行到平衡状态时,那么这个反应的正逆反应速率相等 | |
| C. | 平衡状态是一种静止的状态,因此反应物和生成物的浓度已经不再改变 | |
| D. | 化学反应的限度可以通过改变条件而改变 |
3.海水淡化是指除去海水中的盐分以获得淡水的工艺过程,其方法较多,如反渗透法、电渗析法、离子交换法等,下列方法中也是用来进行海水淡化的是( )
| A. | 过滤法 | B. | 萃取法 | C. | 分液法 | D. | 蒸馏法 |
10.往100mL氢离子浓度为1mol•L-1的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况).则反应前的混合液中含硫酸的物质的量为( )
| A. | 0.01mol | B. | 0.02 mol | C. | 0.03 mol | D. | 0.04 mol |
20.化学与生活密切相关,下列说法不正确的是( )
| A. | 用热的纯碱溶液可洗涤餐具上的油污 | |
| B. | 新制Cu(OH)2悬浊液在医院中常用于尿糖的检测 | |
| C. | 用灼烧并闻气味的方法可区别棉麻织物和纯羊毛织物 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
7.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 蛋白质只含C、H、O、N四种元素 | |
| D. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 |