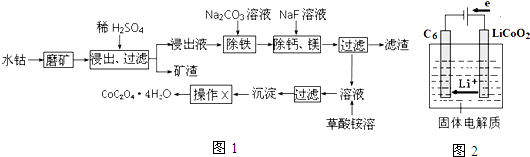
题目内容
9.原子序数为11~17号的元素,随核电荷数的递增,以下各项内容的变化是(1)各元素的原子半径依次减小.
(2)各元素原子的电子层数不变,最外层电子数依次增大.
(3)元素的金属性逐渐减弱,而非金属性逐渐增强,元素失电子能力逐渐减弱.
分析 原子序数11~17号的元素,为第三周期元素,电子层数相等,随核电荷数的递增,最外层电子数增大、原子半径逐渐减小,元素最高正化合价增大.
解答 解:原子序数11~17号的元素,为第三周期元素,电子层数相等,随核电荷数的递增,电子层数不变、最外层电子数依次增大、原子半径逐渐减小,元素最高正化合价依次增大,所以随着核电荷数的递增而逐渐变小的是原子半径,
(1)各元素的原子半径依次减小,故答案为:减小;
(2)各元素原子的电子层数不变,都是三个电子层,最外层电子数由1-8依次增大,故答案为:不变;增大;
(3)同周期从左到右金属性减弱,元素失电子能力逐渐减弱,非金属性逐渐增强,故答案为:减弱;增强;减弱.
点评 本题考查原子结构与元素周期律,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
4.下列热化学方程式中△H表示可燃物燃烧热的是( )
| A. | C(s)+12 O2(g)=CO(g)△H=-110.5 kJ/mol | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| D. | CO(g)+12 O22(g)=CO2(g)△H=-283.0kJ/mol |
14.根据如图判断下列说法正确的是( )
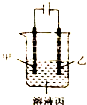

| A. | 若模拟铜的精炼原理,则乙为粗制 | |
| B. | 若模拟电镀原理,则甲为镀层金属 | |
| C. | 若模拟外加电流的阴极保护法防止金属腐蚀,则甲为被保护的金属 | |
| D. | 若甲、乙均为石墨,丙为稀硫酸,则通电一段时间后,硫酸的物质的两浓度减小 |
1.下列现象或反应的原理解释正确的是( )
| 现象或反应 | 原理解释 | |
| A | 锌与盐酸反应时,加入几滴氯化铜溶液可加快反应速率 | 氯化铜作反应的催化剂 |
| B | 将一小块金属钠投入水中,金属钠熔成小球 | 该反应△H>0 |
| C | 镀层破损后,镀锡铁比镀锌铁易腐蚀 | 锡比锌活泼 |
| D | 把铜片插入三氯化铁溶液中,在铜片表面不能出现一层铁 | Cu+2Fe3+=Cu2++2Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法正确的是( )
| A. | 原子的电子层数越多,原子半径一定越大 | |
| B. | 37号元素位于周期表中第五周期 | |
| C. | 同族元素相差的原子序数可能为16、26、36、46 | |
| D. | 卤族元素的单质均有氧化性,最高正价都是+7 |
4.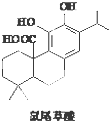 鼠尾草酚可用于防治骨质疏松,结构如图所示,下列说法正确的是( )
鼠尾草酚可用于防治骨质疏松,结构如图所示,下列说法正确的是( )
 鼠尾草酚可用于防治骨质疏松,结构如图所示,下列说法正确的是( )
鼠尾草酚可用于防治骨质疏松,结构如图所示,下列说法正确的是( )| A. | 鼠尾草酚属于芳香烃 | |
| B. | 鼠尾草酚能与FeCl3溶液发生显色反应 | |
| C. | 鼠尾草酚分子式C18H29 O4 | |
| D. | 1mol鼠尾草酚与NaOH溶液反应最多消耗3molNaOH |