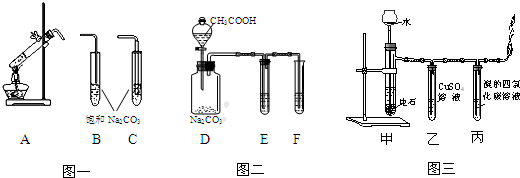
题目内容
19.元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高.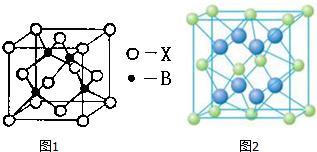
(1)B元素在周期表中的位置第四周期ⅡB族; D的最高价氧化物的水化物的化学式为HBrO4.
(2)E的气态氢化物在同族元素中沸点最高的原因是:HF分子间存在氢键,破坏它需要较高的能量.
(3)A、C两元素第一电离能前者大于后者(填“大于”或“小于”).无论是A和C的单质还是A和C的氢化物的固体,均能与水剧烈反应生成气体,当上述四种固体分别与足量水反应时,满足n(消耗固体):n(气体):n(转移电子)=1:1:1关系的反应的化学方程式KH+H2O=KOH+H2↑.
(4)B元素能形成多种配合物,如B2+可与NH3形成配离子[B(NH3)4]2+.其配体的空间构型为三角锥形;图1表示B与某种元素X形成的化合物晶胞,如果该化合物中B和X通过离子键结合,该晶体中阳离子的配位数为4.
若B和X通过共价键结合,则该化合物的化学式为a(a ZnX b ZnX2 c ZnX3),
(5)A和E可形成离子化合物,其晶胞结构如图2示.该化合物的电子式
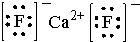 .则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.
.则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.
分析 在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,处于第四周期,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,则A为Ca、C为K,B、D两元素原子的次外层电子数为18,则B为Zn、D为Br,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高,则E为F,据此解答.
解答 解:在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,处于第四周期,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,则A为Ca、C为K,B、D两元素原子的次外层电子数为18,则B为Zn、D为Br,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高,则E为F,
(1)B为Zn元素,核外电子排布式为:1s22s22p63s23p63d104s2,处于周期表中第四周期ⅡB族,D为Br,D的最高价氧化物的水化物的化学式为HBrO4,
故答案为:第四周期ⅡB族;HBrO4;
(2)HF分子间存在氢键,破坏它需要较高的能量,所以沸点较高,
故答案为:HF分子间存在氢键,破坏它需要较高的能量;
(3)A为Ca、C为K,Ca元素原子4s能级容纳2个电子,为全满稳定状态,能量较大,第一电离能高于同周期相邻元素,故第一电离能Ca>K,在KH、CaH2、K、Ca中,分别与足量水反应时,满足n(消耗固体):n(气体):n(转移电子)=1:1:1关系的物质为KH,反应的化学方程式为KH+H2O=KOH+H2↑,
故答案为:大于;KH+H2O=KOH+H2↑;
(4)B为Zn,Zn元素能形成多种配合物,如Zn2+可与NH3形成配离子[Zn(NH3)4]2+,其配体为NH3分子,分子中N原子成3个N-H单键、含有1对孤对电子,杂化轨道数为4,采取sp3杂化,故NH3分子为三角锥型,图1表示Zn与某种元素X形成的化合物晶胞,如果该化合物中B和X通过离子键结合,根据晶胞结构图可知,晶体中阳离子的配位数为4,由晶胞结构可知,晶胞中Zn原子处于晶胞内部,晶胞中含有4个Zn原子,X原子处于顶点与面心,晶胞中X原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故该化合物化学式为ZnX,故选a,
故答案为:三角锥形;4;a;
(5)A为Ca,E为F,A和E可形成离子化合物,其晶胞结构如图2示,则在该晶胞中含有氟离子数为8,钙离子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该化合物为CaF2,它的电子式是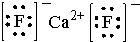 ,根据晶胞的结构图可知,以晶胞顶点的钙离子为例,与钙离子距离相等且最近的氟离子分布在经过该顶点的8个晶胞中,所以氟离子围成的几何体形状是正方体,
,根据晶胞的结构图可知,以晶胞顶点的钙离子为例,与钙离子距离相等且最近的氟离子分布在经过该顶点的8个晶胞中,所以氟离子围成的几何体形状是正方体,
故答案为: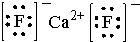 ;正方体.
;正方体.
点评 本题是对物质结构的考查,涉及核外电子排布、元素周期律、分子构型、电子式、晶胞的计算等,解题关键是元素推断,答题时注意元素周期律及晶胞结构的分析.

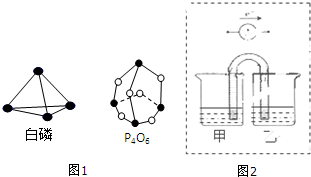
(1)化学反应可视为旧键断裂和新键生成的过程.键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和其燃烧产物P4O6的分子结构如图1所示,现提供以下键能(kJ•mol-1):P-P:198,P-O:360,O-O:498,白磷(P4)燃烧的热化学方程式为P4(s,白鳞)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1.
(2)化学能与电能之间可以相互转化,以Fe,Cu,C(石墨),CuSO4溶液、FeSO4溶液,Fe2(SO4)3溶液、AgNO3溶液为原料,通过原电池反应实现2Fe3++Cu═2Fe2++Cu2+.请你把图2补充完整,使之形成闭合电路,并用元素符号标明电极.电池中电解液时是CuSO4溶液;乙池中电解液是Fe2(SO4)3溶液.(要求:甲乙两池中电解质元素种类始终保持不变)
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
②已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是正反应为吸热反应,升高温度,反应速率加快,平衡右移.
| A. | 溴乙烷的消去反应:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH2═CH2↑+NaBr+H2O | |
| B. | 苯酚钠溶液中通入CO2:2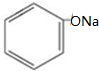 +CO2+H2O→2 +CO2+H2O→2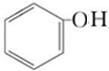 +Na2CO3 +Na2CO3 | |
| C. | 合成聚丙烯塑料:nCH2=CH-CH3$\stackrel{一定条件}{→}$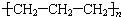 | |
| D. | 乙醛与新制银氨溶液反应:CH3CHO+2Ag(NH3)2OH$\stackrel{水溶液加热}{→}$CH3COONH4+2Ag↓+3NH3+H2O |
| A. | 煤的干馏 | B. | 石油裂解 | ||
| C. | 古代植物变成煤 | D. | 煤焦油中得到苯、甲苯、二甲苯等 |
| A. | 金属钾与水反应:2K+2H2O═2K++2OH-+2H2↑ | |
| B. | 氯气通入碘化钾溶液中:Cl2+2I-═2Cl-+I2 | |
| C. | 铜片放入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 醋酸与碳酸钠溶液反应:2CH3COOH+CO32-═2CH3COO-+H2O+CO2↑ |
 ,判断下列物质不能与B发生化学反应的有C
,判断下列物质不能与B发生化学反应的有C

 .
.