题目内容
10.根据所学知识,完成下列问题:(1)化学反应可视为旧键断裂和新键生成的过程.键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和其燃烧产物P4O6的分子结构如图1所示,现提供以下键能(kJ•mol-1):P-P:198,P-O:360,O-O:498,白磷(P4)燃烧的热化学方程式为P4(s,白鳞)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1.
(2)化学能与电能之间可以相互转化,以Fe,Cu,C(石墨),CuSO4溶液、FeSO4溶液,Fe2(SO4)3溶液、AgNO3溶液为原料,通过原电池反应实现2Fe3++Cu═2Fe2++Cu2+.请你把图2补充完整,使之形成闭合电路,并用元素符号标明电极.电池中电解液时是CuSO4溶液;乙池中电解液是Fe2(SO4)3溶液.(要求:甲乙两池中电解质元素种类始终保持不变)
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
②已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是正反应为吸热反应,升高温度,反应速率加快,平衡右移.
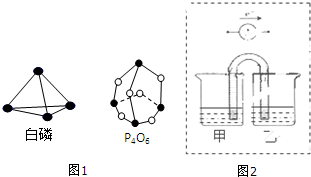
分析 (1)反应热=反应物总键能-生成物总键能,注明物质的聚集状态,书写热化学方程式;
(2)Cu发生氧化反应,为原电池负极,Fe3+发生还原反应,在原电池正极反应,用石墨作正极材料,电子由负极经过导线流向正极,甲池发生氧化反应,应为CuSO4溶液、乙中为Fe2(SO4)3溶液;
(3)①根据电荷守恒判断溶液酸碱性,利用电荷守恒计算溶液中H+离子浓度,若为碱性,忽略氢离子,若为酸性,忽略氢氧根离子,再根据pH=-lgc(H+)计算;
②计算平衡时各组分物质的量,反应前后气体化学计量数不变,利用物质的量代替浓度代入平衡常数表达式K=c2(NO)c(N2)×c(O2)计算;
升高温度,反应速率加快,平衡右移,单位时间内NO排放量增大.
解答 解:(1)发生反应:P4(s,白鳞)+3O2(g)═P4O6(s),反应热△H=6×198kJ•mol-1+3×498 kJ•mol-1-12×360kJ•mol-1=-1638kJ•mol-1,反应热化学方程式为:P4(s,白鳞)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1,
故答案为:P4(s,白鳞)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1;
(2)Cu发生氧化反应,为原电池负极,Fe3+发生还原反应,在原电池正极反应,用石墨作正极材料,电子由负极经过导线流向正极,补充完整装置图为: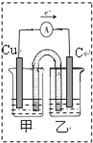 ,甲乙两池中电解质元素种类始终保持不变,甲池发生氧化反应,应为CuSO4溶液、乙中为Fe2(SO4)3溶液,
,甲乙两池中电解质元素种类始终保持不变,甲池发生氧化反应,应为CuSO4溶液、乙中为Fe2(SO4)3溶液,
故答案为: ;CuSO4;Fe2(SO4)3溶液;
;CuSO4;Fe2(SO4)3溶液;
(3)①由电荷守恒可知,c(K+)+c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(Cl-)+2c(SO42-)+c(NO3-),则c(H+)-c(OH-)=(2×10-5 +2×4×10-5 +3×10-5-4×10-6-6×10-6-2×10-5 )mol/L=10-4mol/L,溶液呈酸性,溶液中H+离子浓度约是为10-4,pH值=-lgc(H+)=4,
故答案为:酸性;4;
②N2(g)+O2(g)?2NO(g)
开始(mol):0.8 0.2 0
转化(mol):4×10-4 4×10-4 8×10-4
平衡(mol):0.8 0.2 8×10-4
反应前后气体化学计量数不变,利用物质的量代替浓度计算平衡常数,故K=c2(NO)c(N2)×c(O2)=(8×10−4)20.8×0.2=4×10-6;
正反应为吸热反应,升高温度,反应速率加快,平衡右移,单位时间内NO排放量增大,
故答案为:4×10-6;正反应为吸热反应,升高温度,反应速率加快,平衡右移.
点评 本题考查热化学方程式书写、原电池、溶液酸碱性判断与pH计算、平衡常数计算、化学反应速率与化学平衡影响因素等,属于拼合型题目,需要学生具备扎实的基础,难度中等.

 目标测试系列答案
目标测试系列答案①二氧化碳也是一种重要的资源;
②光能或电能可以转化为化学能;
③燃烧时化学能可以转化为热能和光能;
④无机物和有机物可以相互转化;
⑤化学变化中元素种类是守恒的.

| A. | ①②③ | B. | ①④⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |

(1)蛇文石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 9.6 |
(3)从沉淀混合物A中提取红色氧化物做颜料,先向沉淀物A中加入NaOH或Ca(OH)2(填物质的化学式),然后过滤、洗涤、灼烧(依次填写实验操作名称).
(4)物质循环使用可节约能源.上述实验中,可以循环使用的物质是碳酸钙或二氧化碳(填写物质的名称).
(5)设计一个实验,确定产品a MgCO3•b Mg(OH)2•cH2O中的a、b、c的值.将32.8g产品完全分解后,产生13.2g CO2和16.0g MgO.由此可知,产品的化学式中a:b:c=3:1:3.(填最简整数比)
(1)如图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是C,用O2表示从0~500s内该反应的平均速率v=0.00151mol•L-1•s-1.

| A. | 属于高分子化合物 | |
| B. | 水解后可得到多种氨基酸 | |
| C. | 可用于蛋白质反应机理的研究 | |
| D. | 加入CuSO4溶液后所得的沉淀能用溶于水 |
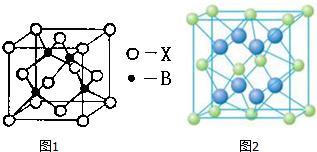
 .则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.
.则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.