题目内容
9.下列离子方程式中,书写不正确的是( )| A. | 金属钾与水反应:2K+2H2O═2K++2OH-+2H2↑ | |
| B. | 氯气通入碘化钾溶液中:Cl2+2I-═2Cl-+I2 | |
| C. | 铜片放入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 醋酸与碳酸钠溶液反应:2CH3COOH+CO32-═2CH3COO-+H2O+CO2↑ |
分析 A.钾与水反应生成氢氧化钾和氢气;
B.氯气可置换出碘;
C.铜与稀硝酸反应生成NO;
D.醋酸为弱酸,与碳酸钠反应生成醋酸钠和二氧化碳和水.
解答 解:A.钾与水反应生成氢氧化钾和氢气,反应的离子方程式为2K+2H2O═2K++2OH-+2H2↑,故A正确;
B.氯气可置换出碘,反应的离子方程式为Cl2+2I-═2Cl-+I2,故B正确;
C.铜与稀硝酸反应生成NO,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C错误;
D.醋酸为弱酸,与碳酸钠反应生成醋酸钠和二氧化碳和水,反应的离子方程式为2CH3COOH+CO32-═2CH3COO-+H2O+CO2↑,故D正确.
故选C.
点评 本题考查离子反应的书写,为高考高频考点,把握发生的化学反应为解答的关键,注意单质、弱电解质、沉淀等在离子反应中保留化学式,注重基础知识的考查,题目难度不大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
17.用下列装置完成相关实验,不合理的是( )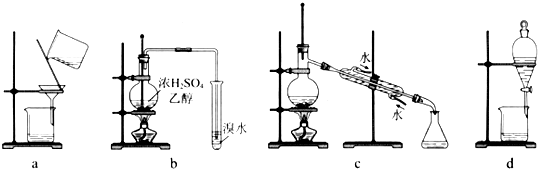

| A. | 用a趁热过滤提纯苯甲酸 | B. | 用b制备并检验乙烯 | ||
| C. | 用c除去溴苯中的苯 | D. | 用d分离硝基苯与水 |
4.已知如表所列元素的原子半径,根据表中数据,推测磷元素的原子半径可能是( )
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10 m | B. | 1.10×10-10 m | C. | 1.20×10-10 m | D. | 0.70×10-10 m |
1.“玉兔”号月球车用${\;}_{94}^{238}$Pu作为热源材料.下列关于${\;}_{94}^{238}$Pu的说法不正确的是( )
| A. | ${\;}_{94}^{238}$Pu的原子核内中子数为144 | |
| B. | ${\;}_{94}^{238}$Pu的原子核内质子数为94 | |
| C. | ${\;}_{94}^{238}$Pu的原子核外电子数为144 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu的化学性质基本相同 |
19.下列不属于低碳经济的是( )
| A. | 太阳能发电 | B. | 火力发电 | C. | 推广节能灯 | D. | 发展核电 |
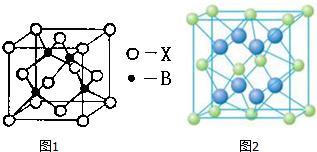
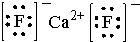 .则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.
.则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.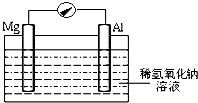 近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展.
近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展.