题目内容
16.下列各组有机物用酸性重铬酸钾溶液即可鉴别的是( )| A. | 乙醇、1-己烯、苯酚 | B. | 正己烷、1-己醇、溴乙烷 | ||
| C. | 乙烯、丙烯、乙烷 | D. | 乙醇、乙醛、乙酸 |
分析 橙色酸性重铬酸钾溶液具有很强的氧化性,被还原后变为灰绿色,其能够氧化碳碳双键、醇羟基、醛基、苯酚等,据此分析.
解答 解:A、乙醇、1-己烯、苯酚都能够使橙色酸性重铬酸钾溶液变为灰绿色,不能鉴别,故A错误;
B、1-己醇能够使橙色酸性重铬酸钾溶液变为灰绿色,正己烷和溴乙烷不能,但正己烷的密度比水小,在溶液上层,溴乙烷的密度比水大,在溶液下层,都是无色液体,故B正确;
C、乙烯和丙烯都能够使橙色酸性重铬酸钾溶液变为灰绿色,无法鉴别,故C错误;
D、乙醇和乙醛都能够使橙色酸性重铬酸钾溶液变为灰绿色,无法鉴别,故D错误;
故选B.
点评 本题考查了有机物的鉴别,注意橙色酸性重铬酸钾溶液具有很强的氧化性,被还原后变为灰绿色,题目难度不大.

练习册系列答案
相关题目
6.(1)将石蜡油与碎瓷片混合共热,产生的混合气体冷却至室温后,其成分如下:
将2mol该混合气体通入足量的溴的四氯化碳溶液中,消耗Br2的物质的量为1mol.
(2)经发现,石蜡与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃生成,0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.则该烃的分子式为C6H12.该烃的同分异构体有多种,其中所有碳原子均处于同一平面的结构简式为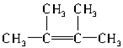 .
.
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
(2)经发现,石蜡与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃生成,0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.则该烃的分子式为C6H12.该烃的同分异构体有多种,其中所有碳原子均处于同一平面的结构简式为
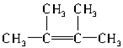 .
.
11.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol; CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H=-282.8kJ/mol.现有CO、H2、CO2组成的混合气体67.2L(标准状况),经充分燃烧后放出的总热量为710.0kJ,并生成18g液态水,求燃烧前混合气体中CO的体积分数为( )
| A. | 80% | B. | 50% | C. | 60% | D. | 20% |
1.下列关于元素周期表的构成说法正确的是( )
| A. | 有9个横行,分为7个周期 | B. | 有7个横行,分为7个周期 | ||
| C. | 有18个纵列,分为18个族 | D. | 有16个纵列,分为16个族 |
8.下列关系不正确的是( )
| A. | 原子半径:K>Na>Mg>N | B. | 酸性:HNO3>H3PO4>H2SiO3 | ||
| C. | 稳定性:HF<H2O<H2S | D. | 酸性:HClO4>H2SO4>H3PO4 |
16.人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),届时人们将适应“低碳经济”和“低碳生活”.下列说法不正确的是 ( )
| A. | 石油和天然气都属于碳素燃料 | |
| B. | 发展太阳能经济有助于减缓温室效应 | |
| C. | 太阳能电池可将太阳能转化为电能 | |
| D. | 目前研究菠菜蛋白质“发电”不属于“太阳能文明” |
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料. 酸性锌锰干电池是以锌筒作为负极,并经汞齐化处理,使表面性质更为均匀,以减少锌的腐蚀.正极材料是由二氧化锰粉、氯化铵及碳黑组成的一个混合糊状物.正极材料中间插入一根碳棒,作为引出电流的导体.由于酸性锰锌干电池制作简单、价格便宜,在干电池市场占有很大份额,但是他也具有一些致命的缺点;存放时间缩短,放电后电压下降较快等,因此废酸性锌猛干电池的综合利用非常重要.上图是某小型化工厂处理废干电池的流程简单示意图:
酸性锌锰干电池是以锌筒作为负极,并经汞齐化处理,使表面性质更为均匀,以减少锌的腐蚀.正极材料是由二氧化锰粉、氯化铵及碳黑组成的一个混合糊状物.正极材料中间插入一根碳棒,作为引出电流的导体.由于酸性锰锌干电池制作简单、价格便宜,在干电池市场占有很大份额,但是他也具有一些致命的缺点;存放时间缩短,放电后电压下降较快等,因此废酸性锌猛干电池的综合利用非常重要.上图是某小型化工厂处理废干电池的流程简单示意图: