题目内容
14.苯酚溶液滴入氯化铁溶液,发生Fe3+(黄色)+6C6H5OH?[Fe(C6H5O)6]3-(紫色)+6H+溶液呈紫色,再加入铁粉或少量氢氧化钠溶液或少量浓盐酸等,都会使紫色褪去.与这些现象无关的是( )| A. | 氧化还原原理 | B. | 溶解沉淀原理 | C. | 平衡移动原理 | D. | 物质两性原理 |
分析 反应中加入铁粉,金属铁可以和铁离子之间发生反应,氢氧化钠可以和铁离子之间反应生成氢氧化铁沉淀,浓盐酸的加入可以增加氢离子的浓度,根据浓度对化学平衡移动的影响来判断即可.
解答 解:反应中加入铁粉,金属铁可以和铁离子之间发生反应,所以平衡逆向移动,使紫色褪去,发生的反应属于氧化还原反应,遵循的是平衡移动原理,并且在加入氢氧化钠之后,可以和苯酚之间发生中和反应,将浑浊物质溶解,属于沉淀溶解原理,没有用到物质两性原理.
故选D.
点评 本题主要考查学生化学平衡移动原理的应用知识,注意知识的迁移和应用是关键,难度中等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案
相关题目
4.如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )
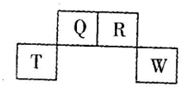

| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中只有共价键没有离子键 | |
| D. | Q可形成多种含氧酸 |
5.下列各组金属与酸的反应,反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
| A | Mg | 0.1 | 3mol•L-1盐酸 | 10mL | 25℃ |
| B | Fe | 0.1 | 3mol•L-1盐酸 | 10mL | 25℃ |
| C | Mg | 0.1 | 3mol•L-1硫酸 | 10mL | 25℃ |
| D | Mg | 0.1 | 6mol•L-1硝酸 | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
2.下列物质中既含有共价键又含有离子键的是( )
| A. | NaOH | B. | H2O | C. | CaCl2 | D. | H2SO4 |
9.新型弹性材料“丁苯吡橡胶”的结构简式如图:
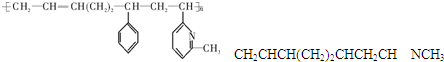
其单体可能是下列6种的几种: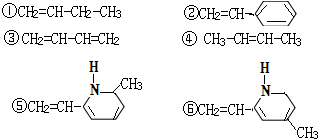
⑥CH2CHNCH3
正确的组合是( )
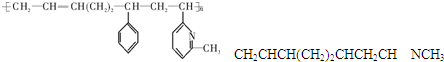
其单体可能是下列6种的几种:

⑥CH2CHNCH3
正确的组合是( )
| A. | ②③⑥ | B. | ②③⑤ | C. | ①②⑥ | D. | ②④⑥ |
6.(1)将石蜡油与碎瓷片混合共热,产生的混合气体冷却至室温后,其成分如下:
将2mol该混合气体通入足量的溴的四氯化碳溶液中,消耗Br2的物质的量为1mol.
(2)经发现,石蜡与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃生成,0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.则该烃的分子式为C6H12.该烃的同分异构体有多种,其中所有碳原子均处于同一平面的结构简式为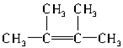 .
.
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
(2)经发现,石蜡与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃生成,0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.则该烃的分子式为C6H12.该烃的同分异构体有多种,其中所有碳原子均处于同一平面的结构简式为
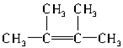 .
. 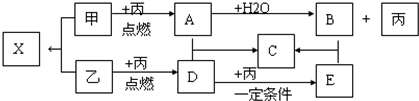
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.