题目内容
16.常温下,以下溶液中c(H+)最小的是( )| A. | pH=0的某溶液 | B. | 0.1 mol•L-1 NaOH 溶液 | ||
| C. | 0.1mol•L-1 HCl 溶液 | D. | 0.1 mol•L-1的 NaCl 溶液 |
分析 A.根据pH=-lgc(H+)计算c(H+);
B.氢氧化钠为强碱,其溶液中氢离子浓度小于最小、酸性溶液;
C.HCl完全电离,溶液中c(H+)=c(HCl);
D.氯化钠为中性溶液,其溶液中氢离子浓度为1×10-7mol/L.
解答 解:A.pH=-lgc(H+)=0,则c(H+)=1mol/L;
B.氢氧化钠溶液为强碱溶液,常温下0.1 mol•L-1 NaOH 溶液中氢离子浓度为:$\frac{1×1{0}^{-14}}{0.1}$mol/L=1×10-13mol/L;
C.HCl为强电解质,在溶液中完全电离,则0.1mol•L-1 HCl溶液中c(H+)=c(HCl)=0.1mol/L;
D.氯化钠溶液中的氢离子浓度为1×10-7mol/L;
根据以上分析可知,氢离子浓度最小为B,
故选B.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度不大,明确溶液酸碱性与溶液pH的关系及溶液pH计算方法为解答关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
12.下列说法不正确的是( )
| A. | 铝原子核外有13种不同运动状态的电子 | |
| B. | 前四周期元素中,基态原子中成对电子数与其所在周期数相同的元素有6种 | |
| C. | 第一电离能介于B、N之间的第二周期元素有3种 | |
| D. | HF的水溶液中存在4种氢键 |
7.新型的乙醇电池结构如图所示,它用碘酸类质子溶剂,在200℃左右时供电,其效率比甲醇电池高出32倍,且更安全.已知电池总反应式为C2H5OH+3O2═2CO2+3H2O.下列说法不正确的是( )
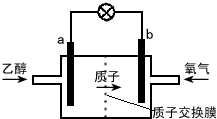

| A. | a极为电池的负极,该电极发生氧化反应 | |
| B. | 电池工作时电子由a极流出沿导线经灯泡到b极 | |
| C. | 电池正极的电极反应式为 O2+2H2O+4e-═4OH- | |
| D. | 电池工作时,1mol乙醇被氧化转移12mol电子 |
4.如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )
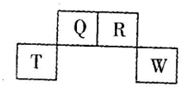

| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中只有共价键没有离子键 | |
| D. | Q可形成多种含氧酸 |
11.下列各组物质中,都是强电解质的是( )
| A. | HBr、Cu(OH)2、BaSO4 | B. | NaOH、Ca(OH)2、NH3•H2O | ||
| C. | HClO、NaF、Ba(OH)2 | D. | NH4Cl、CH3COONa、Na2S |
8.对于反应4NH3+5O2?4NO+6H2O,下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
| A. | v (NH3)=0.2 mol/(L•s) | B. | v (O2)=1.4mol/(L•min) | ||
| C. | v (H2O)=0.25 mol/(L•s) | D. | v (NO)=0.9 mol/(L•min) |
5.下列各组金属与酸的反应,反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
| A | Mg | 0.1 | 3mol•L-1盐酸 | 10mL | 25℃ |
| B | Fe | 0.1 | 3mol•L-1盐酸 | 10mL | 25℃ |
| C | Mg | 0.1 | 3mol•L-1硫酸 | 10mL | 25℃ |
| D | Mg | 0.1 | 6mol•L-1硝酸 | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
6.(1)将石蜡油与碎瓷片混合共热,产生的混合气体冷却至室温后,其成分如下:
将2mol该混合气体通入足量的溴的四氯化碳溶液中,消耗Br2的物质的量为1mol.
(2)经发现,石蜡与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃生成,0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.则该烃的分子式为C6H12.该烃的同分异构体有多种,其中所有碳原子均处于同一平面的结构简式为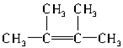 .
.
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
(2)经发现,石蜡与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃生成,0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.则该烃的分子式为C6H12.该烃的同分异构体有多种,其中所有碳原子均处于同一平面的结构简式为
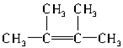 .
.