题目内容
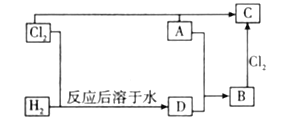
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

请回答下列问题
(1)写出下列物质的化学式A___,E___。
(2)F在空气中转化为G的化学方程式:__。
(3)A和B反应的化学方程式:___。
(4)H和I生成J的离子方程式:___。
(5)如何检验E中大量存在的阳离子?__
【答案】Fe2O3 FeCl2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+Fe2O3![]() 2Fe+Al2O3 Al3++3AlO2-+6H2O=4Al(OH)3↓ 加入KSCN溶液无现象,再加入新制氯水溶液显血红色则证明有Fe2+
2Fe+Al2O3 Al3++3AlO2-+6H2O=4Al(OH)3↓ 加入KSCN溶液无现象,再加入新制氯水溶液显血红色则证明有Fe2+
【解析】
A是一种红棕色金属氧化物,则A是Fe2O3,红褐色沉淀G为Fe(OH)3,氢氧化铁分解可以生成氧化铁,则白色沉淀F是 Fe(OH)2;B、D是金属单质,Fe2O3和B在高温下能反应生成金属单质D,则该反应是铝热反应,B是Al,D是Fe,C是Al2O3,J是一种不溶于水的白色化合物,受热容易分解成C,则J是Al(OH)3,由转化关系可知,I是NaAlO2,H是AlCl3;铁和盐酸反应生成氯化亚铁和氢气,E和氨水反应生成 Fe(OH)2,则E是 FeCl2,以此解答该题。
(1)由以上分析可知,A为Fe2O3,E是FeCl2,故答案为:Fe2O3;FeCl2;
(2)氢氧化亚铁容易被空气中的氧气氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)A是Fe2O3,B为Al,高温下发生铝热反应生成氧化铝和铁: 2Al+Fe2O3![]() 2Fe+Al2O3,故答案为: 2Al+Fe2O3
2Fe+Al2O3,故答案为: 2Al+Fe2O3![]() 2Fe+Al2O3;
2Fe+Al2O3;
(4)Al3+、AlO2发生双水解反应生成氢氧化铝,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(5)E是FeCl2,与KSCN不反应,但可被氧化生成铁离子,检验Fe2+的方法是:先加入KSCN无现象,再加入新制氯水溶液显血红色则有Fe2+,故答案为:加入KSCN溶液无现象,再加入新制氯水溶液显血红色则证明有Fe2+。

【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。

(1)该反应的化学方程式为_____________,此反应平衡常数的表达式为K=________。
(2)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是________,该反应的△H________0。(填“![]() ”、“
”、“![]() ”或“=”)
”或“=”)
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的关系为_______(用“![]() ”、“
”、“![]() ”或“=”连接)。
”或“=”连接)。