题目内容
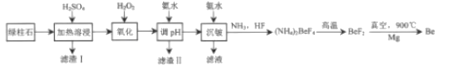
【题目】工业上常用绿柱石(主要成分3BeOAl2O36SiO2,还含有铁元素)冶炼铍,其简化的工艺流程如图所示:
已知:Be和Al性质相似:几种金属阳离子的氢氧化物沉淀时的pH如表:
Be2+ | Al3+ | Fe3+ | Fe2+ | |
开始沉淀时 | 5.2 | 3.3 | 1.5 | 6.5 |
沉淀完全时 | 8.8 | 5.0 | 3.7 | 9.7 |
回答下列问题:
(1)滤渣Ⅰ的主要成分是______,加入H2O2的作用是______。
(2)得到滤渣Ⅱ的合理pH范围是______。
(3)用化学方程式解释不宜使用NaOH溶液来沉铍的原因是______。
(4)得到(NH4)2BeF4的化学方程式为______。
(5)由Mg还原BeF2得到Be需要真空的环境,其原因是______。
(6)若绿柱石中BeO的含量为a%,1吨绿柱石能生产含铍2%的合金b吨,则Be的利用率为______。(用含a、b的表达式表示)
【答案】H2SiO3或SiO2 将Fe2+氧化成Fe3+ 5.0≤pH<5.2或5.0~5.2 Be(OH)2+2NaOH=Na2BeO2+2H2O Be(OH)2+2NH3+4HF=(NH4)2BeF4+2H2O 防止Mg、Be高温下与N2、O2等气体发生反应 ![]()
【解析】
绿柱石中加入稀硫酸,得到滤液中含有Be2+、Al3+、SO42-、含铁元素的离子,SiO2不与稀硫酸反应,且不溶于稀硫酸,或者绿柱石中SiO32-与H+反应生成H2SiO3沉淀,即滤渣1主要成分是H2SiO3或SiO2,向滤液中加入H2O2,利用H2O2的氧化性,将Fe2+转化成Fe3+,便于后续操作除去,根据流程,加入氨水调节pH,除去Al3+、Fe3+,过滤后加入氨水,使Be元素转化成Be(OH)2沉淀,然后让Be(OH)2、NH3、HF反应生成(NH4)2BeF4,据此分析;
绿柱石中加入稀硫酸,得到滤液中含有Be2+、Al3+、SO42-、含铁元素的离子,SiO2不与稀硫酸反应,且不溶于稀硫酸,或者绿柱石中SiO32-与H+反应生成H2SiO3沉淀,即滤渣1主要成分是H2SiO3或SiO2,向滤液中加入H2O2,利用H2O2的氧化性,将Fe2+转化成Fe3+,便于后续操作除去,根据流程,加入氨水调节pH,除去Al3+、Fe3+,过滤后加入氨水,使Be元素转化成Be(OH)2沉淀,然后让Be(OH)2、NH3、HF反应生成(NH4)2BeF4,
(1)滤渣1为H2SiO3或SiO2;加入H2O2的目的是将Fe2+氧化成Fe3+;
(2)得到滤渣II为Fe(OH)3、Al(OH)3,Be元素不能转化成沉淀,根据表中数据,控制的pH范围是5.0≤pH<5.2或5.0~5.2;
(3)Be和Al的性质相似,氢氧化铝表现两性,能与NaOH溶液反应,Be(OH)2也能与NaOH反应,反应方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O;
(4)沉铍中Be元素以Be(OH)2形式存在,根据流程发生Be(OH)2+2NH3+4HF=(NH4)2BeF4+2H2O;
(5)Mg、Be是活泼金属,能与氧气、氮气发生反应,因此需要真空的环境其原因是防止Mg、Be高温下与N2、O2等气体发生反应;
(6)令Be的利用率为x,因此有![]() ,推出Be的利用率为
,推出Be的利用率为![]() 。
。

 习题精选系列答案
习题精选系列答案