题目内容
【题目】钛被称为继铁、铝之后的第三金属,其常见的化合物有钙钛矿、硫酸氧钛(TiOSO4)、钛酸(H2TiO3)、二氧化钛(TiO2)、四氯化钛(TiCl4)等,回答下列问题:
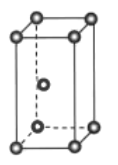
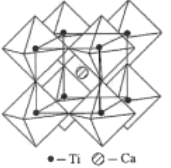
(1)基态钛原子的价层电子排布式为______,金属钛晶体的晶胞结构如图所示,其堆积方式名称为______。
(2)硫酸氧钛的阳离子为TiO2+,其阴离子的VSEPR模型名称为______。TiOSO4在水溶液中不稳定,易生成钛酸沉淀,该反应化学方程式为______。
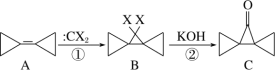
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图:
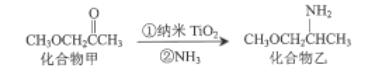
化合物乙种C、N、O元素的第一电离能由大到小的顺序为______。化合物甲的沸点低于化合物乙的沸点,主要原因是______。
(4)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,由此可知TiCl4为______晶体。将TiCl4加入盐酸中,经处理可得到一种配位数为6的绿色晶体TiCl36H2O,1mol该晶体恰好与含2molAgNO3的溶液反应得到白色沉淀,则该绿色晶体中配离子的化学式为______。
(5)钙钛矿的一种晶体结构如图所示。Ti位于立方晶胞的顶点,每个Ti被6个O包围成配位八面体,Ca位于立方晶胞的体心,与Ca距离最近的O有______个;若Ca与Ti的最近核间距为apm,阿伏伽德罗常数为NA,则此钙钛矿的密度为______gcm-3.(列出计算式即可)
【答案】3d24s2 六方最密堆积 正四面体 TiOSO4+2H2O=H2TiO3↓+H2SO4 N>O>C 化合物乙分子间存在氢键 分子 [TiCl(H2O)5]2+ 12 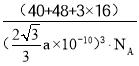 g/cm3或
g/cm3或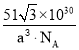 g/cm3
g/cm3
【解析】
(1)钛元素属于过渡元素,价层电子包括最外层电子数和次外层d能级上;根据金属晶体堆积模型进行分析判断;
(2)VSEPR模型的判断是σ键与孤电子对数的和,根据信息完成即可;
(3)同周期从左向右第一电离能逐渐增大,且IIA>IIIA、VA>VIA,据此分析;都属于分子晶体,先看有没有氢键,若没有氢键,从相对分子质量的角度进行分析;
(4)从晶体类型的物理性质上分析TiCl4属于哪种晶体;根据配合物的结构进行分析;
(5)根据晶胞的结构和均摊法进行分析;
(1)钛元素位于第四周期IVB族,价层电子包括次外层d能级和最外层电子数,即Ti的价层电子排布式3d24s2;根据晶胞结构,钛的堆积方式为六方最密堆积;
(2)硫酸氧钛的阴离子为SO42-,价层电子对数=4+![]() =0,VSEPR模型为正四面体;钛酸的化学式为H2TiO3,因此反应方程式为TiOSO4+2H2O=H2TiO3↓+H2SO4;
=0,VSEPR模型为正四面体;钛酸的化学式为H2TiO3,因此反应方程式为TiOSO4+2H2O=H2TiO3↓+H2SO4;
(3) 同周期从左向右第一电离能逐渐增大,且IIA>IIIA、VA>VIA,三种元素的第一电离能由大到小顺序是N>O>C;化合物乙中-NH2能形成分子间氢键,化合物甲不能形成分子间氢键,因此化合物乙的高于化合物甲的沸点;
(4)TiCl4的熔点为-37℃,沸点为136℃,熔沸点较低,所以TiCl4为分子晶体;1mol该晶体恰好与含2molAgNO3溶液生成白色沉淀,说明1mol该物质中有1molCl与Ti形成配位键,Ti的配位数为6,则该配离子为[TiCl(H2O)5]2+;
(5)根据晶胞结构,每条边长的中点是一个氧原子,共12个氧原子,该晶胞中Ca原子个数是1,Ti原子个数为![]() =1,氧原子的个数为
=1,氧原子的个数为![]() =3,其化学式为CaTiO3,Ca与Ti最近的核间距为apm,则体对角线的距离为2apm,根据勾股定理,晶胞的边长为
=3,其化学式为CaTiO3,Ca与Ti最近的核间距为apm,则体对角线的距离为2apm,根据勾股定理,晶胞的边长为![]() pm,晶胞质量为
pm,晶胞质量为![]() ,根据密度的定义,钙钛矿的密度为
,根据密度的定义,钙钛矿的密度为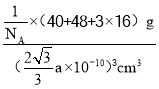 或
或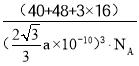 g/cm3或
g/cm3或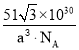 g/cm3。
g/cm3。

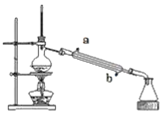
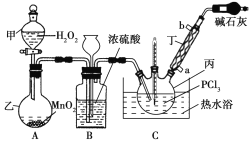
【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。