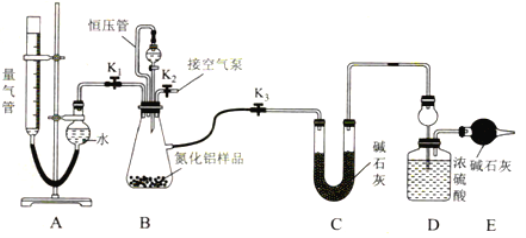
题目内容
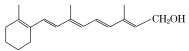
【题目】萜品油烯(D)可用作香料的原料,它可由A合成得到如下所示,下列说法正确的是 ( )
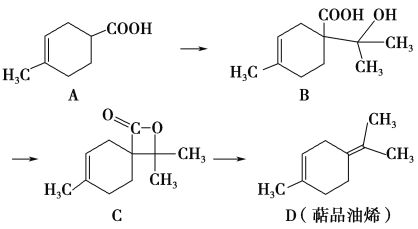
A. 有机物B的分子式为C11H19O3
B. 有机物D分子中所有碳原子一定共面
C. 1 mol有机物A中含有1.204×1024个双键
D. 有机物C的同分异构体中不可能有芳香化合物
【答案】C
【解析】
A.仅含碳、氢、氧元素的化合物中氢原子数不可能为奇数,有机物B的分子式应为C11H18O3,故A错误;B.有机物D分子中的环状结构并不是苯环,有机物D分子中所有碳原子一定不共面,故B错误;C.根据结构简式,A中含有碳碳双键和碳氧双键,1 mol有机物A中含有1mol碳碳双键和1mol碳氧双键,共1.204×1024个双键,故C正确;D.由于有机物C的不饱和度为4,苯环的不饱和度为4,故其同分异构体中可能有芳香化合物,故D错误;故选C。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目