题目内容
【题目】下列关于自然资源开发利用的说法错误的是
A.根据金属活泼性不同,冶炼金属采用的方法不同
B.通过煤的气化和液化等化学变化可将煤变为清洁能源
C.以石油、煤和天然气为原料可生产塑料、合成橡胶和合成纤维
D.从海带中提取碘经历的步骤有:灼烧![]() 浸泡
浸泡![]() 过滤
过滤![]() 萃取
萃取![]() 粗碘提纯
粗碘提纯
【答案】D
【解析】
A.根据金属的活动性强弱选择合适的冶炼方法,一般来说,活泼金属用电解法,如钠、铝等,较活泼金属用热还原法,如铜、铁等,不活泼金属如Hg、Ag等用热分解法冶炼,故A正确;
B.煤的气化是将固体煤转变成CO、![]() 、
、![]() 等可燃气体,属于化学变化,煤的液化是将煤加工成烃类液体燃料和化工原料的过程,属于化学变化,可将煤变为清洁能源,故B正确;
等可燃气体,属于化学变化,煤的液化是将煤加工成烃类液体燃料和化工原料的过程,属于化学变化,可将煤变为清洁能源,故B正确;
C.以煤、石油和天然气为主要原料可制造化工产品、合成塑料、合成橡胶、合成纤维等,故C正确;
D.从海带中提取单质碘,灼烧溶解后以碘离子存在,需要加氧化剂氧化生成碘单质,然后萃取即可,即步骤为灼烧![]() 浸泡
浸泡![]() 过滤
过滤![]() 氧化
氧化![]() 萃取
萃取![]() 分液
分液![]() 粗碘提纯,故D错误;
粗碘提纯,故D错误;
故答案为D。

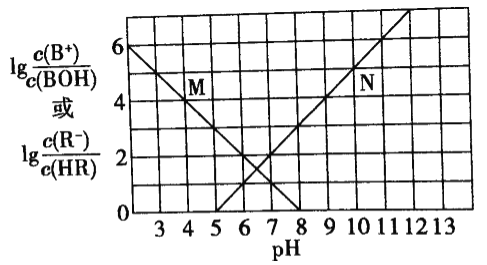
【题目】加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:

(1)已知步骤①反应器发生的反应为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,该反应的还原产物为___;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是___。
温度/℃ | 20 | 40 | 60 | 80 |
KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 244.8 |
(3)①已知:KIO3+3H2SO4+5KI=3K2SO4+3I2+3H2O,I2+2S2O32-=2I-+S4O62-,
测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是___mol·kg-1(以含w的代数式表示)。
②学生乙又进行了下列实验:
操作步骤 | 实验现象 |
取1g纯净的NaCl,加3mL水配制溶液 | 溶液无变化 |
滴入5滴淀粉溶液和1mL0.1mol·L-1KI溶液,振荡 | 溶液无变化 |
然后再滴入1滴1mol·L-1的H2SO4,从发振荡 | 溶液变蓝色 |
请推测实验中产生蓝色现象的可能原因,用离子方程式表示___。
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:___。
(4)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①根据上述实验现象,加碘盐中可能含有的物质中不能确定的是___。
②第二份试液中加入足量KI固体后,反应的离子方程式为___。
【题目】某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是__________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析该图能够得出的实验结论是___________。