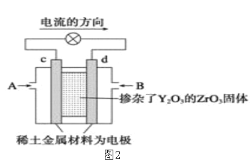
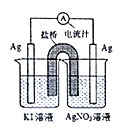
题目内容
【题目】常温下,向1L1nol/L某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的![]() 与pH变化的关系如图所示.下列叙述正确的是
与pH变化的关系如图所示.下列叙述正确的是
A. M线表示![]() 随pH的变化B. BR溶液呈碱性
随pH的变化B. BR溶液呈碱性
C. 若温度升高,两条线均向上平移D. 常温下,0.1mol·L-1NaR溶液的pH=10
【答案】C
【解析】
A.对于一元酸HR![]() H++R-,当温度不变时,Ka=
H++R-,当温度不变时,Ka=![]() 不变;pH越大,c(H+)越小,则
不变;pH越大,c(H+)越小,则![]() 越大,则
越大,则![]() 越大,对比图像可知应为N曲线表示
越大,对比图像可知应为N曲线表示![]() 随pH的变化,故A错误;
随pH的变化,故A错误;
取N曲线上的任意一点,如pH=5时,c(H+)=10-5mol/L;lg![]() =0,
=0,![]() =1;Ka=10-5。
=1;Ka=10-5。
B.曲线M为lg![]() 与pH变化的关系图,取曲线M上的一点计算,如pH=8时,c(OH-)=10-6mol/L; lg
与pH变化的关系图,取曲线M上的一点计算,如pH=8时,c(OH-)=10-6mol/L; lg![]() =0;Kb=10-6;由于Kb<Ka,B+水解程度大于R-,所以BR溶液呈酸性,故B错误;
=0;Kb=10-6;由于Kb<Ka,B+水解程度大于R-,所以BR溶液呈酸性,故B错误;
C.温度升高时,酸碱的电离程度都会变大,![]() 、
、![]() 都变大,故二条线都会上升,C正确;
都变大,故二条线都会上升,C正确;
D.对于NaR溶液: R-+H2O![]() HR+OH-
HR+OH-
起始: 0.1 0 0
平衡: 0.1-x![]() 0.1 x x
0.1 x x
水解常数K=![]() =10-9;
=10-9;![]() =10-9,计算可得x=10-5mol/L,c(H+)=10-9mol/L,pH=9,故D错误。答案选C。
=10-9,计算可得x=10-5mol/L,c(H+)=10-9mol/L,pH=9,故D错误。答案选C。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目