题目内容
【题目】某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是__________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________(填一种方法即可)。
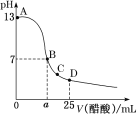
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
分析该图能够得出的实验结论是___________。
【答案】探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或升高相同的温度) 碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
【解析】
(1)根据实验①、②的不同判断影响因素,要使反应发生,可在其中加入、等量催化剂,判断外界条件的影响;
(3)实验③④⑤中都使用了催化剂,双氧水的浓度相同,不同点是溶液酸碱性不同,根据溶液酸碱性与反应产生氧气最大量的时间长短判断反应速率及影响因素。
(1)实验①和②其它外界条件相同,只有H2O2的浓度不同,可见实验的目的是探究浓度对反应速率的影响;根据资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,对原实验方案的改进方法可以是向反应物中加入等量同种催化剂,或适当升高相应的温度;
(2)通过表格数据可知:实验③④⑤中都使用了相同量的同种催化剂,而且双氧水的浓度、体积也都相同,不同点是溶液酸碱性不同。根据图象可知:溶液酸碱性不同,反应快慢不同,产生最大量氧气所需时间不同。溶液呈碱性能增大H2O2分解的速率,溶液呈酸性环境能减小H2O2分解的速率。

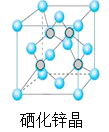
【题目】按要求填空:
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是___,第一电离能最小的元素的电子排布图为___。
(2)以下是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
①![]() ②
②![]() ③
③ ![]() ④
④![]() ⑤
⑤ ![]() ⑥
⑥ ![]()
违反泡利不相容原理的有__,违反洪特规则的有___。
(3)用VSEPR模型和杂化轨道理论相关知识填表:
分子或离子 | 中心原子轨道杂化形式 | 分子或离子的立体结构 | 分子有无极性 |
CH2O | ________ | _______ | _____ |
NH4+ | ________ | _______ | _____ |
CS2 | ________ | _______ | _____ |