题目内容
4.某无色溶液中可能含有以下离子中的一种或几种:Na+、Ag+、Fe3+、NH4+、Al3+、CO32-、AlO2-、S2O32-、SO42-.现取该溶液进行有关实验,实验结果如图所示: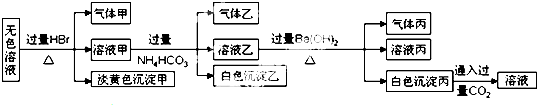
下列说法不正确的是( )
| A. | 淡黄色沉淀甲不可能为AgBr | |
| B. | 由溶液甲生成气体乙的途径只有:Al3++3HCO3-═Al(OH)3↓+3CO2↑ | |
| C. | 气体甲可能是混合气体 | |
| D. | 综合上述信息可以确定肯定存在的离子有:Na+、AlO2-、S2O32- |
分析 由于无色溶液,则一定不存在Fe3+,与过量溴化氢反应生成了气体甲和淡黄色沉淀,沉淀若是溴化银,则不存在S2-、CO32-、SO32-,就不可能生成气体甲,所以淡黄色沉淀为单质硫,是HBr与S2O32-反应生成的,而S2O32-与Ag+、Al3+、NH4+生成沉淀或发生双水解而不能共存,即溶液中一定含S2O32-,一定不含Fe3+、Ag+、Al3+、NH4+,根据电荷守恒,Na+一定存在;
溶液甲中含有过量的溴化氢,与过量的碳酸氢铵反应,生成的气体乙为二氧化碳,白色沉淀只能为氢氧化铝,说明原溶液中一定含有AlO2-;
溶液乙与过量氢氧化钡溶液反应,生成的气体丙为氨气,白色沉淀为碳酸钡或硫酸钡,但由于白色沉淀丙与CO2能反应,故丙为碳酸钡,即原溶液中不含SO42-,
但由于加入的NH4HCO3能引入,故原溶液中含不含CO32-不能确定.
所以溶液中一定存在的离子有:Na+、S2O32-、AlO2-,一定不存在的离子为:Ag+、Fe3+、NH4+、Al3+、SO42-,可能存在的离子为:CO32-.
解答 解:由于无色溶液,则一定不存在Fe3+,与过量溴化氢反应生成了气体甲和淡黄色沉淀,沉淀若是溴化银,则不存在S2-、CO32-、SO32-,就不可能生成气体甲,所以淡黄色沉淀为单质硫,是HBr与S2O32-反应生成的,而S2O32-与Ag+、Al3+、NH4+生成沉淀或发生双水解而不能共存,即溶液中一定含S2O32-,一定不含Fe3+、Ag+、Al3+、NH4+,根据电荷守恒,Na+一定存在;
溶液甲中含有过量的溴化氢,与过量的碳酸氢铵反应,生成的气体乙为二氧化碳,白色沉淀只能为氢氧化铝,说明原溶液中一定含有AlO2-;
溶液乙与过量氢氧化钡溶液反应,生成的气体丙为氨气,白色沉淀为碳酸钡或硫酸钡,但由于白色沉淀丙与CO2能反应,故丙为碳酸钡,即原溶液中不含SO42-,
但由于加入的NH4HCO3能引入,故原溶液中含不含CO32-不能确定.
所以溶液中一定存在的离子有:Na+、S2O32-、AlO2-,一定不存在的离子为:Ag+、Fe3+、NH4+、Al3+、SO42-,可能存在的离子为:CO32-.
A、由于Ag+不能存在,故沉淀甲不可能为AgBr,故A正确;
B、由于原溶液中含AlO2-,故在溶液甲中含过量的H+和反应生成的Al3+,则生成气体乙的途径有两个:Al3++3HCO3-═Al(OH)3↓+3CO2↑,H++HCO3-═CO2↑+H2O,故B错误;
C、由于原溶液中一定含S2O32-,可能还含CO32-,故气体甲中一定含SO2,还可能含CO2,故C正确;
D、溶液中一定存在的离子有:Na+、S2O32-、AlO2-,故D正确.
故选B.
点评 本题考查常见离子的检验及离子组成分的确定,题目难度中等,注意常见离子的检验方法,把握有关离子的性质,会书写反应的离子的方程式.

| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)A分别与D、E、F、G、H形成的化合物中,最稳定的物质是HF
(3)在B、C、E、F、G、H中,原子半径最大的是Mg
(4)A和E组成的最简单化合物的结构式

(5)用电子式表示B和H组成化合物的形成过程

(6)H的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式6H++Al2O3=2Al3++3H2O.
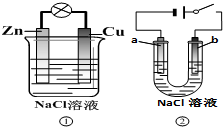
| A. | 装置①中的铜棒上冒气泡 | |
| B. | 若b是惰性电极,则装置②中的a、b 冒气泡 | |
| C. | 装置①换上硫酸铜溶液,将实现锌片上镀铜 | |
| D. | 装置②换上硫酸铜溶液,将实现“b极”镀铜 |
| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中的溶质只有FeSO4 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol.L-1 | D. | 所得溶液中c(Fe2+):c(Fe3+ )=1:1 |
| 物质 组别 | 甲 | 乙 | 丙 |
| A | SO2 | Ba(OH)2 | NaHCO3 |
| B | Na2O2 | H2O | CO2 |
| C | Na2SiO3 | NaOH | HCl |
| D | Al | H2SO4 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
| A. | C6H5OH | B. | H2O | C. | HNO3 | D. | C2H5OH |
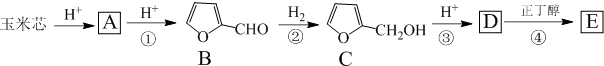
 A、B、C、D是由短周期元素形成的单质.B、E均为组成空气的成分.化合物F的焰色反应呈黄色.在G中,非金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
A、B、C、D是由短周期元素形成的单质.B、E均为组成空气的成分.化合物F的焰色反应呈黄色.在G中,非金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出): .
.
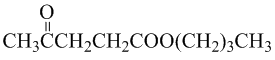 .
.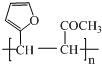 .写出反应的化学方程式
.写出反应的化学方程式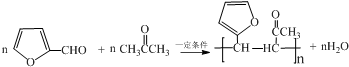 (不必注明反应条件).
(不必注明反应条件).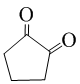 或
或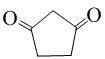 (任写一种).
(任写一种).