题目内容
1.由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质,E为强酸.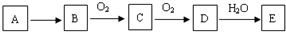
(1)若B为固体,请画出B的原子结构示意图
 ,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.
,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.(2)若B为气体,请写出D→E的化学方程式3NO2+H2O=2HNO3+NO.
分析 由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质,E为强酸,B能连续被氧化生成酸性氧化物D,B可能是氮气或S,
(1)若B为固体,则B为S,A既能与强酸又能与强碱反应,且都能产生气体,A是(NH4)2S或NH4HS、C是SO2、D为SO3、E为H2SO4;
(2)若B为气体,则B为N2、A可能是NH3、C是NO、D是NO2、E是HNO3,
再结合题目分析解答.
解答 解:由短周期元素构成的A~E五种物质中都含有同一种元素,B为单质,E为强酸,B能连续被氧化生成酸性氧化物D,B可能是氮气或S,
(1)若B为固体,则B为S,A既能与强酸又能与强碱反应,且都能产生气体,A是(NH4)2S或NH4HS、C是SO2、D为SO3、E为H2SO4,
S原子核外有3个电子层、最外层电子数是6,其原子结构示意图为 ,A是(NH4)2S或NH4HS,故答案为:
,A是(NH4)2S或NH4HS,故答案为: ;(NH4)2S或NH4HS;
;(NH4)2S或NH4HS;
(2)若B为气体,则B为N2、A可能是NH3、C是NO、D是NO2、E是HNO3,二氧化氮和水反应生成硝酸和NO,反应方程式为3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO.
点评 本题考查无机物推断,涉及S、N元素及其化合物之间的关系,根据B能连续被氧化且E是强酸是解本题关键,熟悉常见元素化合物之间的转化关系及反应条件,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
11.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 石英可导电,用于生产光导纤维 | |
| B. | 常见的氮肥都属于铵盐类无机物 | |
| C. | 粗盐经过溶解、过滤、蒸发结晶,即可得到纯净物氯化钠 | |
| D. | 生活中食用的食醋、植物油、动物蛋白等物质都是混合物 |
12.关于下列装置说法正确的是( )
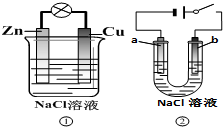

| A. | 装置①中的铜棒上冒气泡 | |
| B. | 若b是惰性电极,则装置②中的a、b 冒气泡 | |
| C. | 装置①换上硫酸铜溶液,将实现锌片上镀铜 | |
| D. | 装置②换上硫酸铜溶液,将实现“b极”镀铜 |
9.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 物质 组别 | 甲 | 乙 | 丙 |
| A | SO2 | Ba(OH)2 | NaHCO3 |
| B | Na2O2 | H2O | CO2 |
| C | Na2SiO3 | NaOH | HCl |
| D | Al | H2SO4 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
16.下列物质中最难电离出H+的是( )
| A. | C6H5OH | B. | H2O | C. | HNO3 | D. | C2H5OH |
6.硫及其化合物用途广泛,许多金属硫化物难溶于水
(1)用硫酸厂的炉渣可制备聚铁[Fe2(OH)2(SO4)]n,聚铁中Fe元素的化合价是+2
(2)工业制Na2S的热化学方程式为:Na2SO4(s)+4C(s)=Na2S(n)+4CO(g)△H=+569.0kj/mol,生成过程中要加入过量的碳,同时还要通入空气,目的有两个,其一是使Na2SO4得到充分的还原(或提高Na2S的产量),其二是空气能够与过量的C反应放热,维持反应进行
(3)常温下工业用Na2SO4溶液吸收SO2尾气,现有吸收过程中,吸收液的pH随n(SO32-):n(HSO3-)的变化关系如表:
根据上表判断NaHSO3溶液显酸性,理由是HSO3-?H++SO32-,显酸性是因其电离大于其水解
(4)已知室温下,H2SO3的电离常数为K1:1.54×10-2 K2:1.024×10-7,H2CO3的电离常数为:K1=4.3×10-7K2=5.6×10-11,则下列微粒不能大量共存的是A(填答案选项的序号)
A.CO32-、HSO3- B.HCO3-、HSO3- C.SO32-、HSO3- D.SO32-、HCO3-
(5)已知:常温下,BaSO4的Ksp=1.1×10-22,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=2.2×10-20mol/L
(6)过二硫酸钾(K2S2O4)常用作氧化剂,K2S2O4溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为5S2O82-+2Mn2++8H2O$\frac{\underline{\;催化剂\;}}{\;}$10SO42-+2MnO4-+16H+.
(1)用硫酸厂的炉渣可制备聚铁[Fe2(OH)2(SO4)]n,聚铁中Fe元素的化合价是+2
(2)工业制Na2S的热化学方程式为:Na2SO4(s)+4C(s)=Na2S(n)+4CO(g)△H=+569.0kj/mol,生成过程中要加入过量的碳,同时还要通入空气,目的有两个,其一是使Na2SO4得到充分的还原(或提高Na2S的产量),其二是空气能够与过量的C反应放热,维持反应进行
(3)常温下工业用Na2SO4溶液吸收SO2尾气,现有吸收过程中,吸收液的pH随n(SO32-):n(HSO3-)的变化关系如表:
| n(SO32-):n(HSO3-) | 91.9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(4)已知室温下,H2SO3的电离常数为K1:1.54×10-2 K2:1.024×10-7,H2CO3的电离常数为:K1=4.3×10-7K2=5.6×10-11,则下列微粒不能大量共存的是A(填答案选项的序号)
A.CO32-、HSO3- B.HCO3-、HSO3- C.SO32-、HSO3- D.SO32-、HCO3-
(5)已知:常温下,BaSO4的Ksp=1.1×10-22,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=2.2×10-20mol/L
(6)过二硫酸钾(K2S2O4)常用作氧化剂,K2S2O4溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为5S2O82-+2Mn2++8H2O$\frac{\underline{\;催化剂\;}}{\;}$10SO42-+2MnO4-+16H+.
10.常温下,足量的铝,分别与下列酸反应时,放出H2最多的是( )
| A. | 600mL 18.4mol/L H2SO4 | B. | 100mL 1mol/L HCl | ||
| C. | 200mL 80% HNO3 | D. | 600mL 0.1mol/L HNO3 |
17.有一瓶K2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量样品溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀.对此实验下述结论正确的是( )
| A. | K2SO3已部分被空气中的氧气氧化 | |
| B. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| C. | 加硝酸后的不溶性沉淀中含有BaSO3 | |
| D. | 此实验不能确定K2SO3是否部分被氧化 |
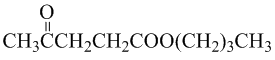 .
.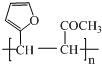 .写出反应的化学方程式
.写出反应的化学方程式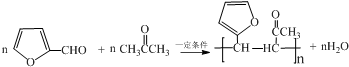 (不必注明反应条件).
(不必注明反应条件).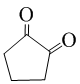 或
或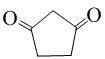 (任写一种).
(任写一种).